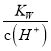题目内容
【题目】(1)科学家最近研制出利用太阳能产生激光,使海水分解。
①太阳光分解海水时,光能转化为_____能,水分解时,断裂的化学键是_____(填“离子键”或“共价键”)
②已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则2H2(g)+O2(g)=2H2O(l) H=_____kJ·mol-1
(2)美国NASA曾开发一种铁·空气电池,其原理如图所示,电池反应为2Fe+O2+2H2O=2Fe(OH)2,
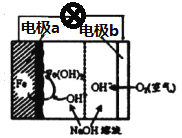
①Fe为原电池的______(填“正极”或“负极”),电极b上发生_____反应(填“氧化”或“还原”)。
②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子数为_________。
【答案】化学 共价键 -571.6 负极 还原 0.8×6.02×1023
【解析】
(1)①利用太阳能分解海水是将太阳能转化为化学能,水分解时,断裂H-0键;
②注意H与热化学方程式化学计量数相对应,化学计量数代表的是物质的量,根据已知进行计算;
(2)①根据负极:升失氧;正极:降得还进行判断。
②铁的化合价从0升高到+2价,计算可得。
(1)①太阳光分解海水时,光能转化为化学能,水为共价化合物,存在O-H键,分解时,断裂的化学键是共价键;
答案:化学 共价键
②已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则
2mol氢气完全燃烧生成液态水放出的热量为2mol×2g/mol×142.9kJ/g=571.6kJ,则
2H2(g)+O2(g)=2H2O(l) H=-571.6kJ·mol-1;
答案:-571.6
(2)根据电极反应式2Fe+O2+2H2O=2Fe(OH)2和图像可知,铁化合价升高失电子发生氧化反应为负极,氧气化合价降低得电子发生还原反应为正极;
①Fe为原电池的负极,电极b上发生还原反应;②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子物质的量为22.4g×2/(56g/mol)=0.8mol,转移电子个数为0.8×6.02×1023;
答案:0.8×6.02×1023

【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 688 | 810 | 860 |
①反应速率最大的时间段是(填0~1、1~2、2~3、3~4、4~5 )_____ min,原因是_____________。
②在2~3min时间段以盐酸的浓度变化来表示的反应速率为_________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列___________以减慢反应速率。(填写代号)
A.冰块 B.HNO3溶液 C.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质,A、B、C的物质的量随时间变化曲线如图。

①该反应的化学方程式是___________
②在该条件达到反应的限度(平衡状态)时反应物的转化率为____________
(转化率=(转化的物质的量/初始物质的量)×100%)(计算结果保留1位小数)