题目内容
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为____________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。
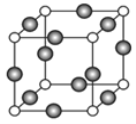
【答案】 A1<Mg<S<N MgCl2为离子晶体而A1C13为分子晶体 sp2 V形 Cu3N ![]()
【解析】本题是以元素的推断考查了分子空间构型的判断、原子的杂化方式的判断等知识点,注意同一周期元素的第一电力能随着原子序数的增大而呈现增大趋势,但是第Ⅱ族和第Ⅲ族、第Ⅴ族和第Ⅵ族之间异常,为易错点。
C元素是地壳中含量最高的金属元素,所以为铝元素,D的原子核外的M层有2对成对电子,且D的原子序数大于铝,所以D为硫,E原子核外最外层只有1个电子,其余各层电子均充满,且E为前四周期的元素,E的原子序数大于16,所以为铜元素,A原子核外有3个未成对电子,且原子序数小于13,所以A为氮元素,A与B可形成离子化合物B3A2,且B的原子序数大于A小于C,所以B为镁元素。(1) 同一周期元素的第一电离能逐渐增大,但镁的第一电离能大于铝的第一电离能,同一主族的第一电离能随着原子序数的增大而减小,所以氮元素的第一电离能大于磷元素,磷元素第一电离能大于硫元素,所以镁、铝、硫、氮元素的第一电离能由小到大的顺序为A1<Mg<S<N;(2)氯化镁是离子晶体,氯化铝是分子晶体,所以离子晶体的熔点远大于分子晶体的熔点; (3)硝酸根离子中价层电子对= ![]() =3,所以采取sp2杂化,D的低价氧化物为二氧化硫,二氧化硫的价层电子对=
=3,所以采取sp2杂化,D的低价氧化物为二氧化硫,二氧化硫的价层电子对= ![]() =3,含有一个孤电子对,所以分子空间构型为V形; (4) 该晶胞中白色球个数为
=3,含有一个孤电子对,所以分子空间构型为V形; (4) 该晶胞中白色球个数为![]() =1,黑色小球个数为
=1,黑色小球个数为![]() =3,氮元素形成的是-3价,所以该晶胞中含有3个亚铜离子1个氮离子,所以其化学式为Cu3N;该晶胞的体积为1个Cu3N的体积,数值为
=3,氮元素形成的是-3价,所以该晶胞中含有3个亚铜离子1个氮离子,所以其化学式为Cu3N;该晶胞的体积为1个Cu3N的体积,数值为![]() ,所以1molCu3N的体积为
,所以1molCu3N的体积为![]() ,该 晶体的密度为
,该 晶体的密度为 ![]() 。
。




