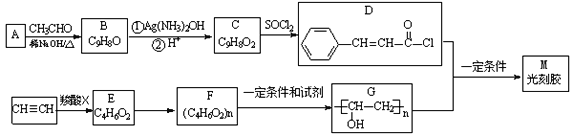
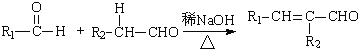
题目内容
【题目】高炉炼铁中常见的反应为![]()
![]() 某实验小组在实验室模拟上述反应。一定温度下,在
某实验小组在实验室模拟上述反应。一定温度下,在![]() 盛有
盛有![]() 粉末的恒容密闭容器中通入
粉末的恒容密闭容器中通入![]() ,5min时生成
,5min时生成![]() 内用CO表示的平均反应速率是______
内用CO表示的平均反应速率是______![]() ;5min时CO的转化率为______;若将此时反应体系中的混合气体通入
;5min时CO的转化率为______;若将此时反应体系中的混合气体通入![]() 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______。
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______。
![]() 上述反应的平衡常数表达式
上述反应的平衡常数表达式![]() ______;判断该反应已经达到平衡状态的依据是______
______;判断该反应已经达到平衡状态的依据是______![]() 填序号
填序号![]() 。
。
![]() 容器内固体质量保持不变
容器内固体质量保持不变 ![]() 容器中气体压强保持不变
容器中气体压强保持不变
![]()
![]()
![]() 已知上述反应的平衡常数K与温度
已知上述反应的平衡常数K与温度![]() 单位:
单位:![]() 之间的关系如图所示。
之间的关系如图所示。
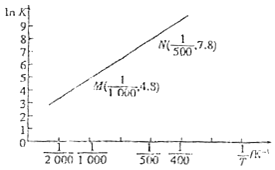
根据图象可知,该反应的平衡常随温度升高而______![]() 填“增大”“减小”或“不变
填“增大”“减小”或“不变![]() 。
。
![]() 结合上述有关信息,指出两条提高CO的平衡转化率的措施:______
结合上述有关信息,指出两条提高CO的平衡转化率的措施:______![]() 写两条
写两条![]()
【答案】![]()
![]()
![]()
![]() ad 减小 降低
ad 减小 降低![]() 的浓度或降低温度
的浓度或降低温度
【解析】
2.24gFe的物质的量为0.04mol,则消耗0.06molCO,根据![]() 计算CO的平均反应速率为;CO的转化率
计算CO的平均反应速率为;CO的转化率![]() ;反应中生成0.06molCO2,通入100mL 0.9mol/L的NaOH溶液中,恰好完全反应生成0.03molNa2CO3和0.03molNaHCO3,根据
;反应中生成0.06molCO2,通入100mL 0.9mol/L的NaOH溶液中,恰好完全反应生成0.03molNa2CO3和0.03molNaHCO3,根据![]() 的水解程度大于
的水解程度大于![]() 的水解程度及溶液呈碱性,即可判断出离子浓度大小关系;
的水解程度及溶液呈碱性,即可判断出离子浓度大小关系;
![]() 纯固体不能代入K的表达式中,据此结合平衡常数概念写出该反应的化学平衡常数表达式;
纯固体不能代入K的表达式中,据此结合平衡常数概念写出该反应的化学平衡常数表达式;
可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(3)根据图象可知,温度越高,lnK越小,即平衡常数越小;
![]() 该反应是放热反应,降低
该反应是放热反应,降低![]() 的浓度或降低温度都能提高CO的平衡转化率。
的浓度或降低温度都能提高CO的平衡转化率。
(1)2.24gFe的物质的量为0.04mol,则消耗0.06molCO,所以CO的平均反应速率为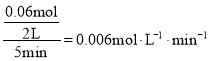 ;CO的转化率为:
;CO的转化率为:![]() ;
;
反应中生成0.06molCO2,通入100mL 0.9mol/L的NaOH溶液中,恰好完全反应生成0.03molNa2CO3和0.03molNaHCO3,,![]() 的水解程度大于
的水解程度大于![]() 的水解程度,溶液呈碱性,则
的水解程度,溶液呈碱性,则![]() 、
、![]() ,溶液中离子浓度大小为:
,溶液中离子浓度大小为:![]() ,
,
故答案为:![]() ;
;![]() ;
;![]() ;
;
![]() 由
由![]() ,纯固体不能代入K的表达式中,则该反应的化学平衡常数表达式为
,纯固体不能代入K的表达式中,则该反应的化学平衡常数表达式为![]() ;
;
![]() 只要反应未达平衡,固体质量就会逐渐减小,当固体质量不变时,反应达到平衡状态,故a正确;
只要反应未达平衡,固体质量就会逐渐减小,当固体质量不变时,反应达到平衡状态,故a正确;
![]() 反应前后气体的物质的量始终不变,故b错误;
反应前后气体的物质的量始终不变,故b错误;
![]() 时,反应不一定达到平衡状态,故c错误;
时,反应不一定达到平衡状态,故c错误;
![]() 说明正、逆反应速率相等,故d正确,
说明正、逆反应速率相等,故d正确,
故答案为:![]() ;ad;
;ad;
(3)根据图象可知,lnK随![]() 增大而增大,而温度越高,
增大而增大,而温度越高,![]() 越小,则该反应的平衡常数随温度升高而减小,
越小,则该反应的平衡常数随温度升高而减小,
故答案为:减小;
![]() 该反应是放热反应,欲提高反应物的转化率,可降低温度;根据平衡移动原理,欲提高CO的转化率,还可以减小生成物的浓度,
该反应是放热反应,欲提高反应物的转化率,可降低温度;根据平衡移动原理,欲提高CO的转化率,还可以减小生成物的浓度,
故答案为:降低![]() 的浓度或降低温度。
的浓度或降低温度。

 口算题天天练系列答案
口算题天天练系列答案【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
【题目】某化学课外小组用如图所示装a制取溴苯并探究该反应的类型。先向分液漏斗中加人苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。
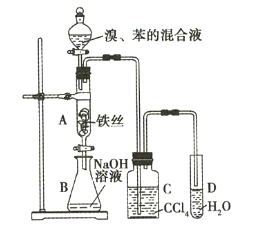
(1)反应结束后,打开A下端的活塞,让反应液流入B中,充分振荡,目的是___。
(2)C中盛放CCl4的作用是___。
(3)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
方法一 | ___ | ___ |
方法二 | ___ | ___ |