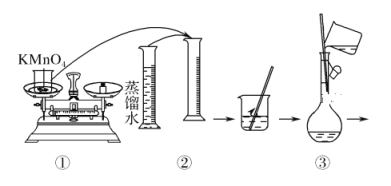
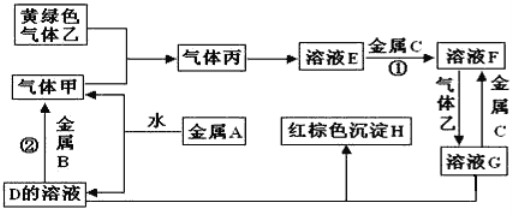
题目内容
【题目】锰钢是工业上非常重要的一 种合金, 其主要成分锰是用软锰矿(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备的,某种生产工艺流程如下图所示 :
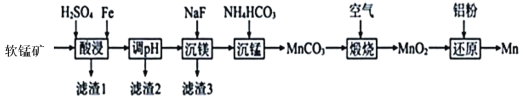
已知:MnO2不溶于稀硫酸,但它可以在酸性条件下和一些还原剂反应生成 Mn2+。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
(1)为了提高锰的浸出率 ,通常需要将软锰矿_______; 酸浸时 MnO2 溶解的离子反应方程式是____________________。
(2)滤渣 2 的主要成分是____________(填化学式)。
(3)沉锰时发生的主要离子反应方程式是________; 沉锰后需要对所得的沉淀进行过滤、洗涤操作,如何检验沉淀己洗净?________________。
【答案】粉碎 3MnO2 + 2Fe + 12H+ = 3Mn2+ + 2Fe3+ + 6H2O Fe(OH)3 和 Al(OH)3 Mn2+ + 2HCO![]() = MnCO3↓+ H2O + CO2↑ 取最后一次洗涤液少许于试管中,加入几滴盐酸酸化的 BaCl2 溶液,若无白色沉淀则洗干净
= MnCO3↓+ H2O + CO2↑ 取最后一次洗涤液少许于试管中,加入几滴盐酸酸化的 BaCl2 溶液,若无白色沉淀则洗干净
【解析】
由生产工艺流程分析可知,软锰矿(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)加入硫酸酸浸,Al2O3、MgO溶于稀硫酸生成Al3+、Mg2+,根据已知条件,MnO2不溶于稀硫酸,但它可以在酸性条件下和一些还原剂反应生成Mn2+,加入Fe发生反应3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O,过滤后的滤渣1主要为SiO2,调节pH使Fe3+和Al3+变成Fe(OH)3和Al(OH)3的沉淀,过滤后加入NaF沉镁,再加入NH4HCO3沉锰得到MnCO3的沉淀,接着通入空气煅烧得到MnO2,最后加入铝粉还原得到Mn,据此分析解答。
(1)可将软锰矿粉碎,从而增大反应物的接触面积,提高锰的浸出率,酸浸时,MnO2不溶于稀硫酸,但它可以在酸性条件下和一些还原剂反应生成Mn2+,加入Fe发生反应3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O,故答案为:粉碎;3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O;
(2)根据上述分析可知,调节pH使Fe3+和Al3+变成Fe(OH)3和Al(OH)3的沉淀,所以滤渣2的主要成分是Fe(OH)3和Al(OH)3,故答案为:Fe(OH)3和Al(OH)3;
(3)沉锰时,加入NH4HCO3得到MnCO3的沉淀,反应的离子方程式为Mn2++2HCO![]() = MnCO3↓+ H2O + CO2↑,沉锰后的沉淀表面附着有
= MnCO3↓+ H2O + CO2↑,沉锰后的沉淀表面附着有![]() ,因此检验沉淀是否洗净的方法为取最后一次洗涤液少许于试管中,加入几滴盐酸酸化的BaCl2溶液,若无白色沉淀则洗干净,故答案为:Mn2++2HCO
,因此检验沉淀是否洗净的方法为取最后一次洗涤液少许于试管中,加入几滴盐酸酸化的BaCl2溶液,若无白色沉淀则洗干净,故答案为:Mn2++2HCO![]() = MnCO3↓+ H2O + CO2↑;取最后一次洗涤液少许于试管中,加入几滴盐酸酸化的BaCl2溶液,若无白色沉淀则洗干净。
= MnCO3↓+ H2O + CO2↑;取最后一次洗涤液少许于试管中,加入几滴盐酸酸化的BaCl2溶液,若无白色沉淀则洗干净。