��Ŀ����
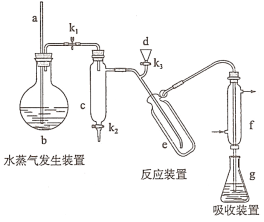
����Ŀ��2019��ŵ������ѧ�������ڿ�������ӵ�ط�������Խ������λ��ѧ�ҡ�ﮱ���Ϊ�����ܽ���������﮵�صĵ缫���ϣ���ҵ������-﮻Կ�(��Ҫ�ɷ�ΪLi2O��Al2O3��4SiO2�Լ������ơ�þ����)�ͷ���ʯ(Ca5P3FO12)������ȡ����ӵ����������(LiFePO4)���乤ҵ����������ͼ��

��֪����Ksp[Al(OH)3]=2.7��10-34��
��LiFePO4������ˮ��
�ش��������⣺
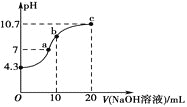
��1������ʯ(Ca5P3FO12)����Ԫ�صĻ��ϼ�Ϊ___������X����Ҫ�ɷ���___(д��ѧʽ)��
��2������3��������___������1����IJ�����������Ϊ___��
��3������Ũ��Li2SO4��Һ��Ŀ����___��
��4��д���ϳɷ�Ӧ�����ӷ���ʽ___��
��5����ѧ�����һ��﮵�صķ�Ӧԭ��ΪLiFePO4![]() Li+FePO4���ŵ�ʱ������ӦʽΪ___��
Li+FePO4���ŵ�ʱ������ӦʽΪ___��
��6����ҵ��ȡ300�ֺ������5%����-﮻Կ�ʯ���������仯�õ�������LiFePO4��110.6�֣���Ԫ��﮵�������Ϊ___��
���𰸡�+5 CaCO3��Mg(OH)2 ��Һ �ձ���©���������� ������Һ�������Ũ�ȣ�����������������﮳��� H2PO4�� + Li+ + Fe2+ = LiFePO4��+ 2H+ FePO4 + Li+ + e�� = LiFePO4 70%
��������
��-﮻Կ��պ�����������������ﮡ�������������ơ�����þ�Ͷ����������������pHΪ6�������ӳ�������Һ������þ�����������Ʒ�Ӧ����������þ������������������̼���Ʒ�Ӧ����̼��Ƴ������õ���Һ���������Ũ�������������李�����������Ӧ�������ܵ�LiFePO4��
�ŷ���ʯ(Ca5P3FO12)��CaΪ+2�ۣ�OΪ-2�ۣ�FΪ-1�ۣ����ݻ������̬������Ϊ0�õ���Ԫ�صĻ��ϼ�Ϊ+5����-﮻Կ��պ�����������������ﮡ�������������ơ�����þ�Ͷ����������������pHΪ6�������ӳ�������Һ������þ�����������Ʒ�Ӧ����������þ������������������̼���Ʒ�Ӧ����̼��Ƴ�������˳���X����Ҫ�ɷݵĻ�ѧʽ��CaCO3��Mg(OH)2���ʴ�Ϊ��+5��CaCO3��Mg(OH)2��
�ƹ۲����̿�֪������1�õ�����ƣ���˲���1Ϊ���ˣ�����IJ����������ձ���©����������������3�õ��л��࣬��˲���3Ϊ��Һ���ʴ�Ϊ����Һ���ձ���©������������
������Ũ��Li2SO4��Һ����ʹ��Һ�������Ũ��������������������﮳������ʴ�Ϊ��������Һ�������Ũ�ȣ�����������������﮳�����
�Ⱥϳɷ�Ӧ���������李���������������ﮣ�����Ϊ���ܵ�LiFePO4�������ӷ���ʽH2PO4�� + Li+ + Fe2+ = LiFePO4��+ 2H+���ʴ�Ϊ��H2PO4�� + Li+ + Fe2+ = LiFePO4��+ 2H+��
�ɿ�ѧ�����һ��﮵�صķ�Ӧԭ��ΪLiFePO4![]() Li+FePO4����LiΪ������FePO4Ϊ�������ŵ�ʱ������ӦʽΪFePO4 + Li+ + e�� = LiFePO4���ʴ�Ϊ��FePO4 + Li+ + e�� = LiFePO4��
Li+FePO4����LiΪ������FePO4Ϊ�������ŵ�ʱ������ӦʽΪFePO4 + Li+ + e�� = LiFePO4���ʴ�Ϊ��FePO4 + Li+ + e�� = LiFePO4��
��300�ֺ������5%����-﮻Կ���Li2O������Ϊ300����5% = 15�֣����ݹ�ϵʽLi2O��2LiFePO4�������Ͽ��������������Ϊ![]() ����Ԫ��﮵�������Ϊ
����Ԫ��﮵�������Ϊ![]() ���ʴ�Ϊ70%��
���ʴ�Ϊ70%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�