题目内容
【题目】下列说法正确的是
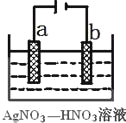
A. 往氢氟酸溶液中加水稀释时,c(F-)/c(H+) 增大
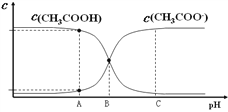
B. 25℃时,0.010 0 mol·L-1 CH3COOH 溶液中,调节溶液pH(忽略体积变化),得到c(CH3COOH) 和 c(CH3COO-)与溶液pH的变化关系如右图所示,A、B、C三点中B对应的溶液抗外界酸、碱的能力最强
C. 将同浓度的Na2CO3、NaHCO3溶液混合后其溶液一定存在2c(H+)+3c(H2CO3)+c(HCO3-)=c(CO32-)+2c(OH-)
D. 已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为 5.6×10-5 mol·L-1,则生成沉淀所需Na2CO3溶液的最小浓度为 5×10-5 mol·L-1
【答案】B
【解析】A.因稀释时一段时间电离产生等量的H+和F-,溶液的体积相同,则两种离子的浓度的比值不变,但随着稀释的不断进行,c(H+)不会超过10-7mol/L,c(F-)不断减小,则比值变小,选项A错误;B.A和C点都不是缓冲溶液,向A和C点溶液中加入酸或碱时,溶液的pH变化幅度较大,B点是缓冲溶液,加入少量酸或碱时,醋酸根离子和氢离子反应,氢离子和氢氧根离子反应,所以能大大降低pH变动幅度,选项B正确;C.Na2CO3溶液中根据质子守恒得c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),NaHCO3溶液存在物料守恒得c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),所以得c(CO32-)+c(OH-)=c(H+)+c(H2CO3),因为碳酸钠和碳酸氢钠的体积未知,则两种物质中氢氧根离子浓度不一定相等,所以混合溶液中的氢氧根离子浓度的计量数不一定是2,选项C错误;D.等体积混合时,溴化钙的浓度是用来的一半,即2.8×10-5mol/L,Na2CO3溶液的最小浓度=![]() mol/L=1×10-4mol/L,选项D错误。答案选B。
mol/L=1×10-4mol/L,选项D错误。答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(2)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈__________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_______________(填“酸性”“碱性”或“中性”),醋酸溶液的体积______(填“>” “<”或“=”)氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)_______氢氧化钠溶液中c(OH-)(填“>” “<”或“=”),m与n的大小关系式_____________________。
【答案】 碱性 > 酸性 < 中性 > < m>n
【解析】本题主要考查弱酸电离及其盐类水解。
(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,形成醋酸钠溶液,醋酸钠水解使溶液呈碱性,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],且碱性溶液中,[H+]<[OH-],所以[Na+]>[CH3COO-]。
(2)醋酸难电离,常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,由于醋酸浓度较大而剩余,醋酸电离使溶液呈酸性,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],且酸性溶液中,[H+]>[OH-],所以[Na+]<[CH3COO-]。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],由于溶液中醋酸根离子和钠离子浓度相等,所以[H+]=[OH-],则混合后溶液呈中性,与(1)比较可知醋酸溶液的体积>氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,由于醋酸难电离,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-),与(1)比较可知m与n的大小关系式为m>n。
【题型】填空题
【结束】
23
【题目】某温度(T℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
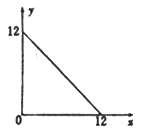
(1)此温度下,水的离子积KW=______________,则该温度T________25℃(填“>” “<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH 如下表所示:
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a=________, 实验②中由水电离产生的[OH-]=______mol·L-1。
(3)在此温度下,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol L-l NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显__________性(填“酸”“碱”或“中”)。
②写出按乙方式混合后,反应的离子方程式:____________________ 。
③按甲方式混合后,所得溶液的pH 为_____________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a________(填“>” “<”或“=”)0.01;用含a的代数式表示HCN 的电离常数Ka=___________。
【题目】运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e- ![]() H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) ![]() H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g) ![]() H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 ![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)一定温度下在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0
4NO2(g)+O2(g) △H>0
①反应达到平衡后若再通入一定量氦气,则N2O5的转化率将_______(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
时间/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol·L—1,则T2___T1。