题目内容
【题目】某同学取海带灰加蒸馏水煮沸2~3 min,冷却,过滤,获得含I的溶液,并设计以下实验方案,从中提取I2。

已知:3I2 + 6NaOH == 5NaI + NaIO3 + 3H2O
(1)试剂a的作用是________。
(2)试剂b应选择________(填序号)。
A.CCl4 B.苯 C.酒精 D.植物油
(3)操作1的名称是________。
(4)反应3的离子方程式是________。
【答案】 将I 氧化成I2(或作氧化剂) A 萃取、分液 5I+ IO3 + 6H+ == 3I2 + 3H2O
【解析】试题分析:由流程可知,含碘离子的溶液先加硫酸酸化,再加氧化剂把碘离子氧化为碘,然后加入萃取剂萃取碘,分液后再向有机层加入氢氧化钠溶液进行反萃取(3I2 + 6NaOH == 5NaI + NaIO3 + 3H2O,生成物易溶于水、不易溶于有机溶剂),再分液,向水层加入硫酸把溶液酸化后得到碘的悬浊液,最后分离得到粗碘。
(1)试剂a的作用是将I 氧化成I2(或作氧化剂)。
(2)由流程中的信息可知,试剂b是密度比水大的萃取剂, CCl4可行,苯和植物油的密度比水小,酒精可溶于水不能作萃取剂,因此选择A。
(3)操作1的名称是萃取、分液。
(4)反应3的离子方程式是5I+ IO3 + 6H+ == 3I2 + 3H2O。

【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。

下列关于实验现象的解释或结论正确的是
选项 | 实验现象 | 解释或结论 |
A | a中无明显现象 | Na2SO3和H2O2一定不发生反应 |
B | b中加稀H2SO4后才产生淡黄色沉淀 | SO32和S2两种离子一定不能大量共存 |
C | c中加BaCl2溶液后产生白色沉淀且红色褪去 | Ba2++ SO32 == BaSO3↓,使SO32水解平衡逆向移动,红色褪去 |
D | d中产生白色沉淀 | 原Na2SO3溶液中含有SO42 |
A. A B. B C. C D. D
【题目】乙酸乙酯是应用非常广泛的有机溶剂,主要用于涂料、油墨、粘合剂、胶片、医药、化工、电子、化妆品及食品行业等。实验室可用乙酸与乙醇反应制备乙酸乙酯。
(1)为判断乙酸乙酯中与乙基(-CH2CH3)相连的氧原子的来源,请没计一种可进行判别的方案__________。(无需给出实验装置实验步骤,只需给出设计思想)。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用下图所示装置进行以下四个实验,实验结束后充分振荡试管II再测有机层的厚度,实验记录如下:
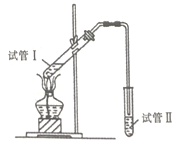
编号 | 试管I中的试剂 | 有机层厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18mol/L浓硫酸 | 3.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①试管II中试剂的名称为_______,其作用是__________。
②分析比较实验_____(填实验编号)的数据,可推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
③分析比较实验C、D,证明对酯化反应具有催化作用的是H+。实验D中应加入盐酸的体积和浓度分别是_______mL和_____mol/L。
(3)现代化工生产探索以CH3CHO为原料,用(CH3CH2O)3Al作催化剂,合成乙酸乙酯:2CH3CHO![]() CH3COOCH2CH3
CH3COOCH2CH3
在实验室中进行该实验时,不同条件下的实验结果如下表所示:
实验序号 | 催化剂用量/g | 反应温度/℃ | 反应时间/h | 副产物/% | 选择性/% | 转化率/% |
1 | 0.368 | 6.5-2 | 52 | 0.35 | 99.9 | 99.6 |
2 | 0.278 | 10-0.5 | 52 | 0.12 | 99.81 | 95.39 |
3 | 0.368 | 6.5-2 | 12 | 0.1 | 99.8 | 99.7 |
4 | 0.368 | 10-0.5 | 52 | 0.8 | 99.5 | 97.3 |
(注)选择性:转化的CH3CHO中生成CH3COOCH2CH3的百分比。
下列说法正确的是_______(填编号)。
A.用乙醛合成乙酸乙酯,可减少“工业三废”的排放
B.温度越高反应速率越快,乙醛的转化率越高
C.用乙醛合成乙酸乙酯的反应时间控制在12h为宜
D.催化剂用量不会影响合成反应的选择性转化率
E.(CH3CH2O)3Al是乙醛制乙酸乙酯的高效催化剂