题目内容
12.氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0(1)如用1图装置制取氨气,选择的试剂可以是BC(填序号).
A.氯化铵固体与消石灰固体 B.浓氨水与碱石灰
C.浓氨水与NaOH固体 D.氯化铵溶液与烧碱溶液
(2)制备氨基甲酸铵的装置如图2,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中.当悬浮物较多时,停止制备.(注:四氯化碳与液体石蜡均为惰性介质)
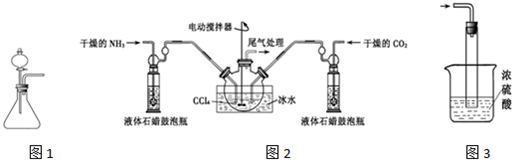
①发生器用冰水冷却的原因是降低温度,促平衡正向移动,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
②尾气处理装置如图3所示.
双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使所有碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为79.80%.
[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100].
分析 本题是利用氨气和二氧化碳在四氯化碳有机溶剂里通过加热制得氨基甲酸铵的制备实验方案的设计,题中涉及到氨气的实验室制备、反应器温度的控制、二氧化碳气流的控制以及反应混合物的分离与提纯,以及产品纯度分析.
(1)装置1是利用分液漏斗滴入液体溶解锥形瓶中的固体,利用溶解放热使氨水分解生成氨气;
(2)①此反应是可逆反应,正反应是放热反应,结合平衡移动理论,为提高反应物的转化率,需降温促平衡正向进行,另外也要考虑产物的不稳定性,降温可避免产物分解;液体石蜡鼓泡瓶的主要作用是控制反应进行程度,控制气体流速和原料气体的配比;
②依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸,另外还可以结合浓硫酸的吸水性和产品易水解考虑;
(3)碳酸氢铵的氨基甲酸铵样品中,使碳元素完全转化为碳酸钙,依据碳原子守恒和混合物质量计算出二者的物质的量,再计算出样品中氨基甲酸铵的物质的量分数.
解答 解:(1)把浓氨水滴入到固体氧化钙或氢氧化钠,在溶解过程中放热使浓氨水分解生成氨气,故选BC;
(2)①反应2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放热反应,降温平衡正向进行,温度升高;发生器用冰水冷却提高反应物质转化率,防止生成物温度过高分解,液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,
故答案为:降低温度,促平衡正向移动,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);通过观察气泡,调节NH3与CO2通入比例;
②氨气易溶于水或酸溶液,容易产物倒吸现象,双通玻璃管的作用是防止液体倒吸;浓硫酸起到吸收多余的氨气,同时防止空气中水蒸气进入反应器使氨基甲酸铵水解,
故答案为:防止倒吸;吸收多余氨气;防止空气中水蒸气进入反应器使氨基甲酸铵水解;
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,碳酸钙物质的量为$\frac{1.000g}{100g/mol}$=0.010mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,依据碳元素守恒得到$\left\{\begin{array}{l}{x+y=0.01}\\{78x+79y=0.7820}\end{array}\right.$,解得x=0.008mol y=0.002mol,则样品中氨基甲酸铵的物质的量分数为$\frac{0.008mol×78g/mol}{0.7820g}$×100%=79.80%,
故答案为:79.80%.
点评 本题考查了物质制备实验的设计应用,主要是氨气的制备方法,氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,有关混合物的计算,题目难度中等.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案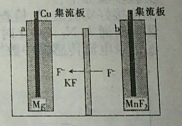
| A. | b为负极 | |
| B. | 该电池放电时,Cu集流板上Cu失电子 | |
| C. | 充电时,F-通过交换膜从b极区移向a极区 | |
| D. | 充电时,阳极的电极反应式为2MnF2+2F--2e-═2MnF3 |
| A. | 0.2 mol•L-1 的H2SO4溶液 | |
| B. | 0.2 mol•L-1 的HNO3溶液 | |
| C. | 0.2 mol•L-1 的H2SO4和HNO3混合溶液 | |
| D. | 1 mol•L-1 的H2SO4和HNO3混合溶液 |
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
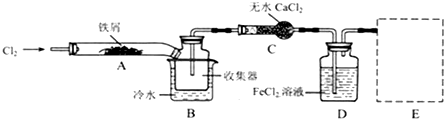
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(2)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤.
(3)如果没有装置C的设计,会导致D装置中水挥发到接受器,使FeCl3潮解.
(4)用离子方程式表示虚线框E中所增加装置和试剂的作用:
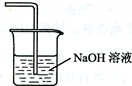 、Cl2+2OH-=Cl-+ClO-+H2O.
、Cl2+2OH-=Cl-+ClO-+H2O.(5)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,请写出反应的离子方程式:2Fe3++2H2S=2Fe2++2H++S↓.
Ⅱ.反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③既有Fe3+又有Fe2+.
为探究溶液的组成,实验如下:
| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液. | 溶液中出现红色. | 说明:假设②不成立,假设①或③成立; 反应的离子方程式是Fe3++3SCN-=Fe(SCN)3. |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液. | 溶液紫红色退去 | 说明:假设②或③成立. |
| A. | Cu2+、Mg2+、SO42-、NO3- | B. | NH4+、Ba2+、SO42-、OH- | ||
| C. | K+、Na+、MnO4-、S2- | D. | Na+、Ca2+、NO3-、Cl- |