题目内容
4.下列图甲框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子.据此回答下列问题: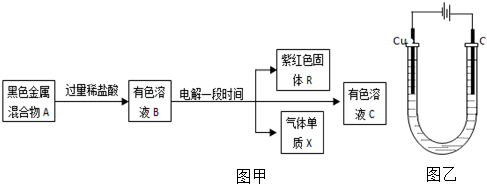
(1)A的组成是Fe3O4、CuO(填化学式).
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是Fe3+>Cu2+>H+>Fe2+.
(3)A中某组分可由单质与水反应制得,化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(4)电解所用装置如图乙所示.
①电解开始阶段,阳极上的电极反应是2Cl--2e-=Cl2↑,阴极上的电极反应是2Fe3++2e-=2 Fe2+.
②电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小的顺序是Fe2+>Cu2+.
分析 (1)常见的黑色金属氧化物有氧化铁和氧化铜等;
(2)单质的还原性越强则离子的氧化性越弱,处于最高价的元素具有较强的氧化性;
(3)单质铁可以和水蒸气反应生成四氧化三铁和氢气;
(4)①电解池中阳极发生氧化反应,阴极发生还原反应;
②在阴极上,氧化性强的离子先放电.
解答 解:(1)常见的黑色金属氧化物有氧化铁和氧化铜等,根据溶液B的电解结果可知A的组成是Fe3O4、CuO,
故答案为:Fe3O4、CuO;
(2)单质的还原性越强则离子的氧化性越弱,所以氧化性:Cu2+>H+>Fe2+,三价铁处于最高价,具有的氧化性比铜离子强,
故答案为:Fe3+>Cu2+>H+>Fe2+;
(3)单质铁可以和水蒸气反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(4)①电解池中阳极为惰性电极时,阳极是阴离子发生失电子的氧化反应,阴极是阳离子发生得电子的还原反应,
故答案为:2Cl--2e-=Cl2↑; 2Fe3++2e-=2 Fe2+;
②在阴极上,氧化性强的离子先放电,即先发生的电极反应为:Fe3++e-=Fe2+,然后为Cu2++2e-=Cu,阴极刚开始有固体铜析出时,三价铁已全部装化为二价铁,所以Fe2+浓度最大,其次是Cu2+,
故答案为:Fe2+>Cu2+.
点评 本题是一道有关物质性质的推断题,题目难度中等,思维空间广,考查学生对知识点的理解程度.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
14.某氢氧燃烧电池的电解质溶液为KOH溶液,下列有关该电池的叙述正确的是( )
| A. | 电池工作时,OH-向正极移动 | |
| B. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液的PH变大 | |
| D. | 用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mole-转移 |
12.将SO2、H2S、NH3、HCl分别收集于等体积的四个容器中,用导管把四个容器连成一个整体,若使各种气体充分混合(前后条件均相同),混合后容器中的压强与原容器中的压强之比为( )
| A. | 1:1 | B. | 1:2 | C. | 3:4 | D. | 1:8 |
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
 .
.