题目内容
4. 金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示:
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示:(1)等物质的量的金刚石和石墨完全燃烧金刚石(填“金刚石”或“石墨”)放出热量更多,在通常状况下,金刚石和石墨相比石墨(填“金刚石”或“石墨”)更稳定.请写出表示石墨燃烧热的热化学方程式C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ?mol-1,.
(2)已知:Fe2O3(s)+$\frac{3}{2}$C(石墨,s)═$\frac{3}{2}$CO2(g)+2Fe(s)△H=+234.1kJ•mol-1,则
Fe2O3(s)═2Fe(s)+$\frac{3}{2}$O2(g)的△H=+824.4
kJ•mol-1.
(3)24g石墨在一定量空气中充分燃烧,生成气体72g,该过程放出的热量504 kJ.
分析 (1)图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为△H=-393.5kJ?mol-1;
(2)(2)Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s)△H=+234.1kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
由盖斯定律-②×$\frac{3}{2}$+①得:Fe2O3(s)═2Fe(s)+$\frac{3}{2}$O2(g)△H=-(-393.5kJ•mol-1)×$\frac{3}{2}$+234.1kJ•mol-1;
(3)24g石墨物质的量为2mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为88g,若生成一氧化碳质量为56g,生成气体72g,56g<72g<88g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(2-x)mol,28x+44(2-x)=72g,x=1mol,二氧化碳物质的量为1mol.
解答 解:(1)金刚石能量高于石墨,所以等物质的量的金刚石和石墨完全燃烧,金刚石放出热量多;能量越低越稳定,所以说明石墨稳定,石墨的燃烧热为△H=-393.5kJ?mol-1,所以石墨燃烧热的热化学方程式为:C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ?mol-1,
故答案为:金刚石;石墨;C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ?mol-1;
(2)Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s)△H=+234.1kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
由盖斯定律-②×$\frac{3}{2}$+①得:Fe2O3(s)═2Fe(s)+$\frac{3}{2}$O2(g)△H=-(-393.5kJ•mol-1)×$\frac{3}{2}$+234.1kJ•mol-1
即Fe2O3(s)═2Fe(s)+$\frac{3}{2}$O2(g)△H=+824.4kJ•mol-1,
故答案为:+824.4;
(3)24g石墨物质的量为2mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为88g,若生成一氧化碳质量为56g,生成气体72g,56g<72g<88g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(2-x)mol,28x+44(2-x)=72g,x=1mol,二氧化碳物质的量为1mol;依据图象可知C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 、C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1 ,生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJ•mol-1 ×1mol+110.5 kJ•mol-1 ×1mol=504KJ,故答案为:504.0.
点评 本题考查了化学反应能量变化的图象分析计算,热化学方程式的书写方法,掌握基础是关键,题目难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案①根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据物质能否导电将化合物分为电解质和非电解质.
| A. | ①② | B. | ①③ | C. | ② | D. | ①②③ |
| A. | N2O | B. | NO | C. | NH4NO3 | D. | N2 |
| A. | 加聚反应也可能有水生成 | |
| B. | 水、乙醇、氢氧化钠中都存在羟基 | |
| C. | 王水、溴水、水银、水晶中均含有“H2O” | |
| D. | 在某些有机反应中,水可能是反应物也可能是生成物 |
| A. | 500 mL容量瓶 | B. | 胶头滴管 | C. | 试管 | D. | 托盘天平 |
| A. | 在热化学方程式中,物质化学式前面的化学计量数可以为整数也可以为简单分数 | |
| B. | 同一化学反应,热化学方程式中物质的化学计量数不同,反应的△H也不同 | |
| C. | 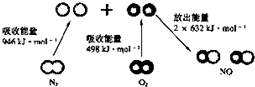 N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 | |
| D. | 化学反应中化学键的断裂和形成是反应过程中有能量变化的本质原因 |