题目内容
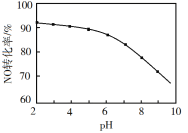
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
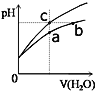
A.a、b、c三点溶液的离子浓度之和a>b>c
B.b点溶液中c(H+)+c(NH3·H2O)= c(OH-)
C.用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc
D.a、b、c三点溶液中水的电离程度 a>b>c
【答案】AD
【解析】
盐酸溶液中的氢离子主要是盐酸电离出来的,盐酸完全电离,体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;水解是微弱的,氯化铵溶液中铵离子可继续水解,溶液中的氢离子浓度变化小,所以含c点的曲线pH变化是盐酸溶液的,含a、b点的曲线pH变化是氯化铵溶液的。
A.由于a点溶液稀释后得到b点,故b点的离子浓度小于a点;而氯化铵溶液的浓度远大于HCl,而氯化铵溶液是由于水解显酸性,而HCl是由于完全电离显酸性,故b和c点pH相同,故b点氯化铵的浓度必须远大于c点HCl的浓度,故离子浓度之和的大小关系为a>b>c,故A正确;
B.b点溶液中,根据质子守恒,得出c(OH)+c(NH3H2O)=c(H+),故B错误;
C.用等浓度NaOH溶液和等体积b、c处溶液反应,b点为铵根水解导致溶液呈酸性,b点溶液中铵根和氢离子均消耗NaOH,而c点只有盐酸消耗NaOH(盐酸完全电离),故消耗NaOH溶液体积Vb>Vc,故C错误;
D.盐酸电离出的氢离子浓度抑制了水的电离,所以c点溶液中水的电离程度最小;水解促进水的电离,由于氯化铵溶液中的氢离子浓度来自于铵根离子水解生成的氢离子,氢离子浓度越大,说明水解程度越大,水的电离程度越大,a点的pH<b点的pH,说明a点酸性大于b点酸性、a点氢离子大于b点氢离子,所以a、b二点溶液水的电离程度a>b,综上所述a、b、c三点溶液水的电离程度a>b>c,故D正确;
答案选AD。

 阅读快车系列答案
阅读快车系列答案【题目】准确称量8.2g含有少量中性易溶杂质的烧碱样品,配成500mL待测溶液。用0.1000molL1的硫酸溶液进行中和滴定测定该烧碱样品的纯度,试根据试验回答下列问题:
(1)滴定过程中,眼睛应注视____________,若用酚酞作指示剂达到滴定终点的标志是____________。
(2)根据表数据,计算烧碱样品的纯度是_______________(用百分数表示,保留小数点后两位)
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL)) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(3)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果________。