题目内容
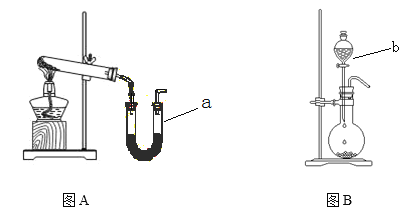
【题目】利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物)。请填写下列空白:

(1)检验乙醛的试剂是_________;(选填编号)
a.银氨溶液 b.碳酸氢钠溶液 c.新制氢氧化铜 d.氧化铜
(2)乙醇发生催化氧化的化学反应方程式为____________;
(3)实验开始时,是先鼓入空气还是先点燃酒精灯加热铜丝?_____________,原因是_________;该实验中“鼓气速度”这一变量你认为可用______来估量;
(4)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是_______。以下实验需要水浴加热的是_________;(选填编号)
a.卤代烃水解 b.银镜反应 c. 乙酸丁酯 d.苯的硝化反应
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色(假设两者恰好完全反应)。该同学为解释上述现象,提出两种猜想:① 溴水将乙醛氧化为乙酸;② 溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?__________________________。
【答案】ac 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 先点燃酒精灯加热铜丝 先产生氧化铜使乙醇反应更充分 单位时间内甲中的气泡量 使生成乙醇蒸气的速率加快且较均匀 bd 用pH试纸检测溴水与褪色后溶液的酸碱性。若酸性明显增强,则猜想①正确;反之,猜想②正确
2CH3CHO+2H2O 先点燃酒精灯加热铜丝 先产生氧化铜使乙醇反应更充分 单位时间内甲中的气泡量 使生成乙醇蒸气的速率加快且较均匀 bd 用pH试纸检测溴水与褪色后溶液的酸碱性。若酸性明显增强,则猜想①正确;反之,猜想②正确
【解析】
(1)含有醛基的物质能够发生银镜反应,能够与新制的氢氧化铜反应;
(2)乙醇催化氧化生成乙醛和水;铜与氧气反应生成氧化铜,氧化铜与乙醇反应生成乙醛;
(3)先点燃酒精灯加热铜丝生成氧化铜,能够使乙醇更充分的反应;该实验中“鼓气速度”这一变量可用单位时间内甲中的气泡量来估测;
(4)水浴加热可以让乙醇在一定的温度下成为蒸气,从而加快反应的速率;依据反应条件判断解答;
(5)若是乙醛被氧化,则有乙酸和溴化氢生成,溶液呈强酸性;若是发生加成反应,则生成饱和含溴有机物,溶液仍为中性,故可利用酸碱指示剂来确定哪种猜想是正确的;
(1)乙醛含有醛基,能够发生银镜反应,与新制的氢氧化铜反应生成砖红色沉淀,所以通常用银氨溶液、新制的氢氧化铜检验;
(2)乙醇催化氧化生成乙醛和水,化学方程式:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)铜与氧气反应生成氧化铜,氧化铜与乙醇反应生成乙醛,先点燃酒精灯加热铜丝生成氧化铜,能够使乙醇更充分的反应;该实验中“鼓气速度”这一变量可用单位时间内甲中的气泡量来估测;
(4)将甲装置浸在70℃~80℃的水浴中,使生成乙醇蒸气的速率加快且较均匀;水浴加热温度为小于100度,
a.卤代烃水解反应条件为加热,不需要水浴加热,故a不符合题意;
b.银镜反应需要的温度不超过100℃,故可以用水浴加热,故b符合题意;
c.制取乙酸丁酯需要的温度较高,需要用酒精灯直接加热,不能用水浴加热,故c不符合题意;
d.苯和浓硝酸、浓硫酸在50℃~60℃发生硝化反应生成硝基苯和水,应用水浴加热,故d符合题意;
故答案选bd;
(5)乙醛具有还原性,乙醛被溴水氧化生成乙酸和HBr,溶液呈酸性,乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应,没有HBr生成,溶液不呈酸性,所以检验褪色后溶液的酸碱性,确定其发生哪类反应,用pH试纸检测溴水与褪色后溶液的酸碱性.若酸性明显增强,则猜想①正确,反之猜想②正确。

【题目】工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________;阴极产生NaOH_________mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________。