题目内容
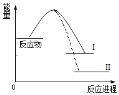
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备时目前的研究热点。某工艺利用电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2.下列有关描述不合理的是
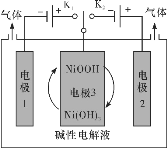
A.制H2时,产生H2的电极反应式:2H2O+2e-=H2↑+2OH-
B.制O2时,电极3要连接K2
C.若没有电极3,K1和K2直接相连,一样可以得到H2和O2
D.上述过程,若用酸性电解质一样可以实现上述过程
【答案】D
【解析】
A.制取氢气时,阴极上得电子生成氢气,电极反应式为2H2O+2e-═H2↑+2OH-,故A正确;
B.制取氧气时,阳极上得电子生成氧气,所以该电极应该连接原电池正极,所以电极3连接K2,故B正确;
C.如果没有电极3,K1和K2直接连接,电极1是阴极、电极2为阳极,阴极上生成氢气、阳极上生成氧气,所以一样可以得到H2和O2,故C正确;
D.①中电极3发生Ni(OH)2-e-+OH-=NiOOH+H2O,制氢气时消耗电极1产生的OH-,②中电极3发生NiOOH+H2O+e-=Ni(OH)2+OH-,制氧气时补充电极2消耗的OH-,制氧气时补充电极2消耗的OH-,实现NiOOHNi(OH)2的转化,且可循环使用,Ni(OH)2和酸反应,所以酸性条件下不能实现上述目的,故D错误;
故答案为D。

【题目】工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________;阴极产生NaOH_________mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________。