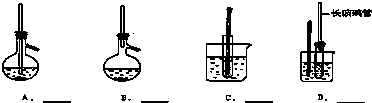题目内容
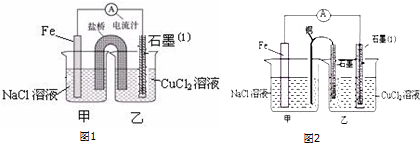
2.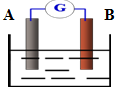 如图为某原电池装置:
如图为某原电池装置:(1)若A为Zn,B为石墨,电解质溶液为稀硫酸,则A极的电极反应式为Zn-2e-=Zn2+.
(2)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,则铜片为正极(填正或负);该极电极反应式为Fe3++e-=Fe2+.
分析 (1)若A为Zn,B为石墨,电解质溶液为稀硫酸,该原电池中,Zn易失电子作负极、石墨作正极,所以A电极上锌失电子生成锌离子进入溶液;
(2)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,Fe易失电子作负极、Cu作正极,正极上铁离子得电子生成亚铁离子.
解答 解:(1)若A为Zn,B为石墨,电解质溶液为稀硫酸,该原电池中,Zn易失电子作负极、石墨作正极,所以A电极上锌失电子生成锌离子进入溶液,电极反应式为,故答案为:Zn-2e-=Zn2+;
(2)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,Fe易失电子作负极、Cu作正极,正极上铁离子得电子生成亚铁离子,电极反应式为Fe3++e-=Fe2+,故答案为:正; Fe3++e-=Fe2+.
点评 本题考查原电池原理,为高频考点,侧重考查电极反应式的书写,正确判断正负极及各个电极上发生的反应是解本题关键,会正确书写电极反应式,题目难度不大.

练习册系列答案
相关题目
2.向一份FeCl2溶液中滴加少量KSCN(SCN是“类卤离子”,性质与卤素离子相似)溶液,再向此溶液中逐滴滴加酸性KMnO4溶液,产生现象如下:①溶液逐渐变为红色;②红色逐渐褪去;③溶液又逐渐变色.关于上述现象的解释不正确的是( )
| A. | ①溶液逐渐变红色的原因是Fe2+被酸性KMnO4溶液氧化 | |
| B. | ②红色逐渐褪去的原因是酸性KMnO4溶液将SCN-氧化 | |
| C. | ②红色逐渐褪去的原因是酸性KMnO4溶液将Cl-氧化 | |
| D. | ③溶液又逐渐变色且为紫色 |
13.设nA为阿伏加德罗常数的数值,下列说法错误的是(H:1 O:16)( )
| A. | 常温下,1.8g H2O含有0.2nA个H-O共价键 | |
| B. | 1L 0.3 mol•L-1的FeCl3溶液中Fe3+数目为0.3nA | |
| C. | 标准状况下,22.4L CCl4中含 nA个CCl4分子 | |
| D. | 标准状况下,22.4L NO2和CO2的混合气体含有2nA个氧原子 |
10. 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
Ⅰ.产物种类探究
在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为中的一种或两种.
资料2:
(1)由上述资料2可得出的正确结论是abd(选填下列字母编号)
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度>15mol•L-1
d.硫酸浓度越大,黑色物质出现越快,越难消失
(2)Cu与足量16mol•L-1浓硫酸反应时,在80°C以后,随着温度的逐渐升高,反应中硫酸铜的生成逐渐增加,而CuS却逐渐减少,到达250°C左右时,CuS在反应中完全消失的澄清溶液,CuS消失的化学方程式为CuS+4H2SO4=CuSO4+4SO2↑+4H2O.
Ⅱ.产物性质探究
Cu与浓H2SO4反应生成的CuSO4具有某些特定性质,一定浓度CuSO4溶液与NaHCO3溶液反应后生成蓝绿色颗粒状沉淀,沉淀可能是CuCO3,Cu(OH)2,或者CuCO3与Cu(OH)2的混合物.
(1)若沉淀是Cu(OH)2,生成沉淀的离子方程式是Cu2++2HCO3-=Cu (OH)2↓+2CO2↑.
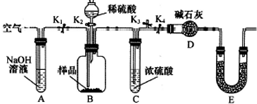
(2)为了进一步探究沉淀的成分,设计的实验装置如图:
实验操作步骤为
a.取沉淀样品100克于B中,检查装置的气密性
b.打开K1,K3,关闭K2,K4,通入足量空气
c.关闭K1,K3,打开K2,K4,充分反应
d.反应结束后,关闭K2,打开K1,再通入足量空气
e.测得装置D的质量增加了22g
①步骤b的作用是排尽装置中空气中的CO2使测定结果准确
②若沉淀样品为CuCO3和Cu(OH)2的混合物,则Cu(OH)2的质量分数为38%,若不进行步骤d,则会使测得Cu(OH)2的质量分数为偏低(填“偏高”“无影响”“偏低”)
 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.Ⅰ.产物种类探究
在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为中的一种或两种.
资料2:
硫酸/mol•L-1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度>15mol•L-1
d.硫酸浓度越大,黑色物质出现越快,越难消失
(2)Cu与足量16mol•L-1浓硫酸反应时,在80°C以后,随着温度的逐渐升高,反应中硫酸铜的生成逐渐增加,而CuS却逐渐减少,到达250°C左右时,CuS在反应中完全消失的澄清溶液,CuS消失的化学方程式为CuS+4H2SO4=CuSO4+4SO2↑+4H2O.
Ⅱ.产物性质探究
Cu与浓H2SO4反应生成的CuSO4具有某些特定性质,一定浓度CuSO4溶液与NaHCO3溶液反应后生成蓝绿色颗粒状沉淀,沉淀可能是CuCO3,Cu(OH)2,或者CuCO3与Cu(OH)2的混合物.
(1)若沉淀是Cu(OH)2,生成沉淀的离子方程式是Cu2++2HCO3-=Cu (OH)2↓+2CO2↑.
(2)为了进一步探究沉淀的成分,设计的实验装置如图:
实验操作步骤为
a.取沉淀样品100克于B中,检查装置的气密性
b.打开K1,K3,关闭K2,K4,通入足量空气
c.关闭K1,K3,打开K2,K4,充分反应
d.反应结束后,关闭K2,打开K1,再通入足量空气
e.测得装置D的质量增加了22g
①步骤b的作用是排尽装置中空气中的CO2使测定结果准确
②若沉淀样品为CuCO3和Cu(OH)2的混合物,则Cu(OH)2的质量分数为38%,若不进行步骤d,则会使测得Cu(OH)2的质量分数为偏低(填“偏高”“无影响”“偏低”)
17.已知2SO2+O2?2SO3是一个正反应放热的可逆反应.如果反应在密闭容器中进行,则下列有关途述正确的是( )
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 升高温度可加快逆反应速率但不能改变正反应速率 | |
| C. | 一定条件下,SO2可100%转化为SO3 | |
| D. | 任何条件下,反应达到平衡,SO2的浓度一定等于SO3的浓度 |
14.相同状况下,某气态烃1体积只能与1体积氯气发生加成反应,生成氯代烃,此氯代烃1mol可与6mol氯气发生完全取代反应,则该烃的结构简式是( )
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH3CH2CH=CH2 |