题目内容
4.过氧化镁(MgO2)为白色粉末,不溶于水,易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.MgO2可由以下反应制得:MgO+H2O2═MgO2+H2O
Ⅰ.过氧化镁的制备:制备流程如图1所示:
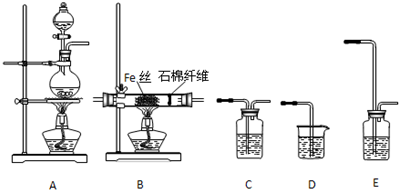
(1)用图2所示装置进行煅烧,仪器A的名称是坩埚.
(2)某研究小组为了研究Mg2(OH)2CO3煅烧条件对合成MgO2的影响.设计实验如下表所示(所取固体质量均为ag),其他条件不变时,探究煅烧温度对合成MgO2的影响,可选择实验①③(填实验编号).
| 实验编号 | 煅烧温度(℃) | 煅烧时间(h) |
| ① | 550 | 2 |
| ② | 600 | 1 |
| ③ | 650 | 2 |
| ④ | 700 | 3 |

(3)某研究小组拟用图3装置测定一定质量的样品中过氧化镁的含量.
①实验前需进行的操作是检查装置的气密性,稀盐酸中加入少量FeCl3溶液的作用是用作催化剂.
②用恒压分液漏斗的优点有:消除滴入溶液的体积对所测气体体积的影响;使分液漏斗中的溶液顺利滴下.
(4)实验室还可通过下列方案测定样品中过氧化镁的含量:
称取1.600g产品于锥形瓶中,加入15mL蒸馏水和足量稀硫酸,用0.5000mol•L-1 KMnO4标准溶液滴定至终点.反应的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
①滴定终点观察到的现象为当滴入最后一滴KMnO4溶液后溶液由无色变为浅红色,且半分钟内不褪色.
②根据图4计算产品中的质量分数为89.25%.
分析 (1)煅烧固体应该在坩埚中进行;
(2)研究Mg2(OH)2CO3煅烧条件对合成MgO2的影响,要选择只有一个条件不同其它条件要相同的组进行对比实验;
(3)图3装置测定一定质量的样品中过氧化镁的含量的方法为用样品与盐酸反应,在氯化铁做催化剂的条件下生成氧气,根据生成氧气的体积计算过氧化镁的质量,进而确定品中过氧化镁的含量,所以要准确测量出氧气的体积,实验前需进行装置气密性检查,用恒压分液漏斗的优点有:消除滴入溶液的体积对所测气体体积的影响,保持恒压液体能顺利流下,据此答题;
(4)该实验的原理 为用样品中的过氧化镁与酸反应生成过氧化氢,用高锰酸钾溶液滴定生成的过氧化氢,高锰酸钾溶液为紫红色溶液,可以作为滴定终点的判断依据,根据用掉的高锰酸钾的体积可计算出样品过氧化镁的质量,据此答题.
解答 解:(1)煅烧固体应该在坩埚中进行,所以仪器A的名称是坩埚,
故答案为:坩埚;
(2)研究Mg2(OH)2CO3煅烧条件对合成MgO2的影响,要选择只有一个条件不同其它条件要相同的组进行对比实验,结合题中表格中的数据可知,应选择①③,在温度不同,时间相同的条件做对比实验,可判断出温度对反应的影响,
故答案为:①③;
(3)图3装置测定一定质量的样品中过氧化镁的含量的方法为用样品与盐酸反应,在氯化铁做催化剂的条件下生成氧气,根据生成氧气的体积计算过氧化镁的质量,进而确定品中过氧化镁的含量,所以要准确测量出氧气的体积,
①装置连接完毕后,进行气密性检验的方法为向量气管中加水到右端液面高出左端液面,若液面不发生变化,则气密性良好,根据上面的分析可知,稀硫酸中加入少量FeCl3溶液作用是催化剂,
故答案为:检查装置的气密性,用作催化剂;
②用恒压分液漏斗的优点有:消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下,
故答案为:使分液漏斗中的溶液顺利滴下;
(4)该实验的原理 为用样品中的过氧化镁与酸反应生成过氧化氢,用高锰酸钾溶液滴定生成的过氧化氢,依据高锰酸钾本身的颜色变化可判断滴定终点,根据用掉的高锰酸钾的体积可计算出样品过氧化镁的质量,
①滴定终点观察到的现象为当滴入最后一滴高锰酸钾溶液后溶液由无色变为浅红色,且30s不褪色,
故答案为:当滴入最后一滴高锰酸钾溶液后溶液由无色变为浅红色,且30s不褪色;
②根据图4可知,滴定用去高锰酸钾溶液的体积为20.4mL,根据反应2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,得关系式5MgO2~5H2O2~2MnO4-,所以的物质的量为$\frac{5}{2}$×20.4mL×10-3×0.5000mol•L-1=2.55×10-2mol,所以产品中MgO2的质量分数为$\frac{2.55×1{0}^{-2}×56}{1.6}$×100%=89.25%,
故答案为:89.25%.
点评 本题考查了实验探究和实验测定的过程分析判断,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力;该类试题主要是以常见仪器的选用、实验基本操作为中心,重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | 欲制备Fe(OH)3 胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| B. | 用碘的水溶液鉴别乙醇、四氯化碳 | |
| C. | 欲配制质量分数为10%的CuSO4溶液,将l0 g CuSO4•5H2O 溶解在90 g 水中 | |
| D. | 为减小误差,容量瓶必须干燥后才可使用 |
 苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理如图1和实验主要装置如图2:
苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理如图1和实验主要装置如图2:已知:①甲苯为无色澄清液体,微溶于水,沸点110.6℃.
②苯甲酸的熔点为122.4℃.
③苯甲酸在25℃和95℃时的溶解度分别为0.17g和6.8g.
实验流程:
Ⅰ、往三颈烧瓶中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,回流反应4小时.
Ⅱ、将反应混合物趁热过滤,洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作B得白色较干燥粗产品.
Ⅲ、纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol•L-1KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)仪器A的名称(球形)冷凝管;
(2)判断甲苯被氧化完全的实验现象是甲苯层消失,回流液不再有明显的油珠;
(3)洗涤时,下列洗涤剂最合适的是B
A、冷水 B、热水 C、乙醇 D、乙醇-水混合物
(4)根据实验流程Ⅱ,回答下列两个问题:
①操作B的名称过滤;
②如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是将过量的KMnO4反应掉,防止其与浓盐酸反应;
(5)实验所得的苯甲酸在结晶过程中常裹携KCl析出,除去产品中KCl的实验方法的名称是重结晶;
(6)样品中苯甲酸纯度为96.00%.
①HF(aq)+OH-(aq)?F-(aq)+H2O(1)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ/mol
下列有关说法中正确的是( )
| A. | HF电离吸热 | |
| B. | 水解消耗0.1 mol F时,吸收的热量为6.77 kJ | |
| C. | 中和热均为57.3 kJ/mol | |
| D. | 含0.1 mol HF、0.1 mol NaOH的两种溶液混合后放出的热量为6.77 kJ |
| A. | 氯化铁溶液保存时加入少量的盐酸 | B. | 氯水保存在棕色瓶里并放在冷暗处 | ||
| C. | 漂白粉可以在敞口容器中长期存放 | D. | 溴水盛放在有玻璃塞的细口瓶中 |
 ),乳酸在微生物作用下分解为CO2和H2O.
),乳酸在微生物作用下分解为CO2和H2O.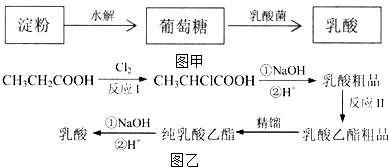
 乳酸在一定条件下发生反应得到聚乳酸的化学方程式是n
乳酸在一定条件下发生反应得到聚乳酸的化学方程式是n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.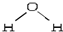 ,折线型结构,正负电荷的重心不能重合,因此为极性分子;CO2的结构式为 O═C═O,正负 电荷的重心重合,为非极性分子.又知极性分子易溶于极性分子中,而非极性分子易溶于非极性分子中,叫相似相溶原理.
,折线型结构,正负电荷的重心不能重合,因此为极性分子;CO2的结构式为 O═C═O,正负 电荷的重心重合,为非极性分子.又知极性分子易溶于极性分子中,而非极性分子易溶于非极性分子中,叫相似相溶原理.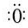 →
→ .
.