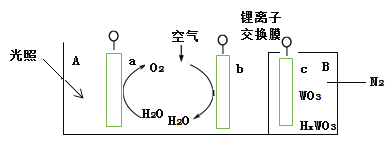
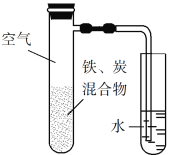
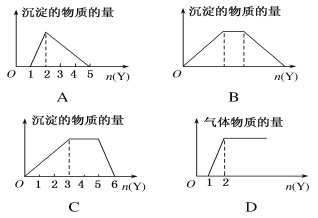
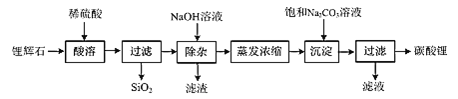
题目内容
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g) CO(g)+ 3H2(g)。
(1)一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl __P2(填“<”、“>”“=”);A、B、C三点处对应平衡常数(KA、KB、KC)由大到小的顺序为___。

(2)100℃时,将1 mol CH4和2 mol H2O通入容积固定为10 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则H2的反应速率v(H2)=____。100℃时该反应的平衡常数K =____。反应达到平衡的标志是:____。
A.容器内气体密度恒定 B.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
C.容器的压强恒定 D.3v正(CH4)= v逆(H2)
(3)为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有____(填编号)。
A.升高温度 B.缩小容器体积
C.再充入CH4气体 D.使用合适的催化剂
【答案】< KC>KB>KA 0.03 mol·L-1·min-1 0.0225 CD B
【解析】
(1)温度不变,随着压强增大,平衡逆向移动,甲烷的平衡转化率减小,所以Pl <P2,随着温度升高,平衡转化率增大,说明平衡常数变大,即KC>KB>KA;
(2)甲烷的消耗量为0.5mol,则根据方程式分析,生成1.5mol氢气,则用氢气表示的反应速率为 ;
;

 ;
;
A. 根据质量守恒定律,反应前后气体的质量不变,在恒容体系中气体体积不变,所以密度不变,A错误;
B. 单位时间内消耗0.1 mol CH4同时生成0.3 molH2均表示正反应速率,B错误;
C. 容器的压强恒定可以说明体系内各组分的含量不再改变,C正确;
D. 3v正(CH4)= v逆(H2),则说明正逆反应速率相等,D正确;
故答案选CD;
(3)A. 升高温度平衡正向移动,体系中气体物质的量增加,A错误;
B. 缩小容器体积,反应速率加快,平衡逆向移动,气体物质的量减小,B正确;
C. 再充入CH4气体,反应速率增加,平衡正向移动,气体物质的量增加,C错误;
D. 加入催化剂,反应速率加快,平衡不移动,D错误;
故答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案