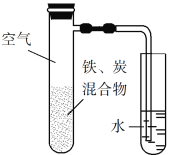
题目内容
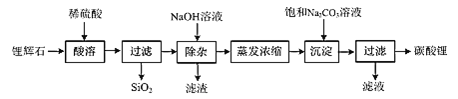
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为___。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH___(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___。冰晶石的作用是___。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阴极产生的物质A的化学式为___;电解时,若阴极生成标况下44.8L的A,则阳极产生NaHCO3的质量为___g。

【答案】Al2O3+2OH-→H2O+2AlO2- 减小 石墨电极被阳极上产生的氧气氧化 作助熔剂,降低电解液工作时的温度 H2 336
【解析】
结合流程及题中信息可知,铝土矿在碱溶时,其中的Al2O3和SiO2可与强碱溶液反应,二氧化硅和强碱溶液反应后转化为沉淀,氧化铝和氢氧化钠反应后得到可溶于水的偏铝酸钠,过滤后,滤液中的NaAlO2与NaHCO3反应生成氢氧化铝沉淀和Na2CO3,氢氧化铝经灼烧后得到Al2O3,最后电解熔融的Al2O3得到铝。Na2CO3溶液经电解后可以再生成NaHCO3和NaOH进行循环利用,据此分析解答。
(1)“碱溶”时,铝土矿中的Al2O3和SiO2能够与氢氧化钠反应,其中生成偏铝酸钠的离子方程式为Al2O3+2OH-→H2O+2AlO2-,故答案为:Al2O3+2OH-→H2O+2AlO2-;
(2)“过滤Ⅰ”所得滤液中主要含有偏铝酸钠和氢氧化钠,加入NaHCO3溶液,三者反应生成氢氧化铝沉淀和碳酸钠,溶液的碱性减弱,pH减小,故答案为:减小;
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中,阳极上生成氧气,能够氧化石墨生成二氧化碳,因此作阳极的石墨易消耗。氧化铝的熔点很高,加入冰晶石,冰晶石作助熔剂,可以降低电解液工作时的温度,故答案为:石墨电极被阳极上产生的氧气氧化;作助熔剂,降低电解液工作时的温度;
(4)“电解Ⅱ”是电解Na2CO3溶液,阳极上是溶液中的氢氧根离子放电生成氧气4OH--4e-=2H2O+O2↑,阴极上是溶液中的氢离子放电生成氢气,2H++2e-=H2↑或2H2O+2e- = H2↑+ 2OH-;若阴极生成标况下44.8L的氢气,氢气的物质的量为![]() =2mol,转移4mol电子,阳极上有4mol氢氧根离子放电,则阳极产生4molNaHCO3,质量为4mol×84g/mol=336g,故答案为:H2;336。
=2mol,转移4mol电子,阳极上有4mol氢氧根离子放电,则阳极产生4molNaHCO3,质量为4mol×84g/mol=336g,故答案为:H2;336。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。