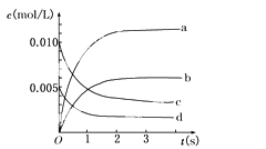
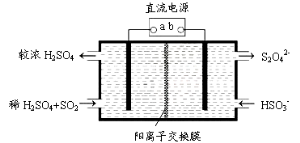
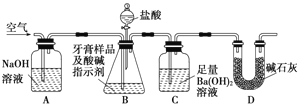
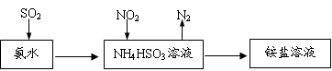题目内容
【题目】(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。被氧化的元素是 ,氧化剂是 ,还原产物是 。电子转移的总数为__________。
(2)国家卫生部在2000年前就决定逐步使用稳定、高效、无毒的二氧化氯取代氯气消毒饮用水。已知二氧化氯溶于水时有亚氯酸根离子(ClO2-)生成,且氧化产物与还原产物的物质的量之比为1∶1。二氧化氯溶于水的反应方程式2ClO2 + H2O=HClO3 + HClO2,请用单线桥标明电子转移方向和数目并指出氧化产物。2ClO2 + H2O=HClO3 + HClO2
【答案】
(1)C KNO3、S K2S、NO2 4
(2)![]() 氧化产物:HClO3
氧化产物:HClO3
【解析】
试题分析:(1)反应2KNO3+C+S═K2S+2NO2↑+CO2↑中,N和S元素化合价降低,被还原,则KNO3和硫为氧化剂,还原产物为K2S和NO2,C元素化合价升高,被氧化,C为还原剂,CO2为氧化产物,每1mol C转移4mol电子。
(2)在反应2ClO2 + H2O=HClO3 + HClO2中,1分子的ClO2价态升高得到HClO3,另一分子的ClO2价态降低得到HClO2,ClO2既是氧化剂又是还原剂,转移1个电子。

练习册系列答案
相关题目