题目内容
【题目】化学计量是化学学习中的重要工具,请根据物质的量有关知识填空(NA表示阿伏伽德罗常数)
(1) _____molCO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)标准状况下,体积为11.2L的N2的质量是_____g,所含质子数目为___。
(3)0.2L0.5mol/LAl2(SO4)3溶液和0.5L 0.5mol/L Na2SO4溶液,所含SO42—离子的物质的量浓度之比为____。
(4)标准状况下,NH3和CH4组成的混合气体的密度为0.75g/L,则NH3的体积分数为___。
(5)标准状况下,将VLA气体(摩尔质量为M g/ mol )溶于0.1L水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为____mol/L。
【答案】1.5 14 7NA 3:1 80% ![]() 1
1
【解析】
根据物质的量及阿伏伽德罗常数的意义进行分析计算,根据溶液中溶质的组成进行有关物质的量浓度的相关计算。
(1)![]() ,则n(CO2)=1/2 n(H2O)=1/23mol=1.5mol,故答案为:1.5;
,则n(CO2)=1/2 n(H2O)=1/23mol=1.5mol,故答案为:1.5;
(2)![]() ,
,![]() ,氮原子中质子数等于核电荷数等于7,则所含质子总数为720.5molNA=7NA,故答案为:14;7NA;
,氮原子中质子数等于核电荷数等于7,则所含质子总数为720.5molNA=7NA,故答案为:14;7NA;
(3)0.5mol/LAl2(SO4)3溶液中c(SO42-)=0.5mol/L3=1.5mol/L,0.5mol/L Na2SO4溶液中c(SO42-)=0.5mol/L,则浓度之比为1.5mol/L:0.5mol/L=3:1,故答案为:3:1;
(4)混合气体的平均摩尔质量![]() ,则
,则![]() ,解得
,解得![]() ,则NH3的体积分数为
,则NH3的体积分数为![]() ,故答案为:80%;
,故答案为:80%;
(5)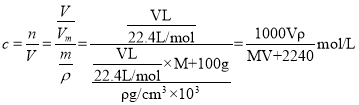 ,故答案为:
,故答案为:![]() 。
。

【题目】汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=__。
②请写出CO和NO生成无污染气体的热化学方程式为__。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)![]() 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
时间(min) 浓度(mol/L) 实验序号/温度 | 0 | 10 | 20 | 30 | 40 | 50 |
实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
①下列说法正确的是__。
A.实验2容器内压强比实验1的小
B.在0→10mim内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是__。
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将__(填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
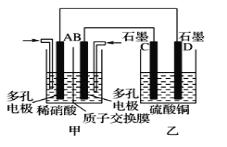
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为__(填化学式);A电极的电极反应式为__。