题目内容
8.室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )| A. | 若pH>7,则一定是c1V1≥c2V2 | |
| B. | 在任何情况下都是c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| C. | 当醋酸和氢氧化钠溶液恰好完全反应后,滴加酚酞溶液,颜色变红 | |
| D. | 反应的离子方程式为:H++OH-═H20 |
分析 A.当溶液呈碱性时,溶液中氢离子浓度小于氢氧根离子浓度,但混合时醋酸的物质的量不一定等于氢氧化钠的物质的量;
B.溶液呈电中性,溶液中阴阳离子所带电荷相等;
C.恰好反应时生成醋酸钠,醋酸钠是强碱弱酸盐,其水溶液呈碱性;
D.醋酸为弱酸,离子方程式中醋酸不能拆开.
解答 解:A.醋酸是弱酸,氢氧化钠是强碱,所以等物质的量的酸和碱混合时,溶液呈碱性,当氢氧化钠过量时溶液更呈碱性,所以当pH>7时,则一定是c1V1≥c2V2,故A正确;
B.溶液呈电中性,溶液中阴阳离子所带电荷相等,所以得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故B正确;
C.二者恰好反应生成醋酸钠,醋酸钠是强碱弱酸盐,其水溶液呈碱性,所以滴加酚酞溶液,颜色变红,故C正确;
D.醋酸与氢氧化钠反应生成醋酸钠和水,醋酸需要保留分子式,正确的离子方程式为:CH3COOH+OH-═H20+CH3COO-,故D错误;
故选D.
点评 本题考查了酸碱混合溶液的定性判断,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确溶液中物料守恒和电荷守恒即可解答本题,该知识点为考试的热点.

练习册系列答案
相关题目
8.下列化学用语正确的是( )
| A. | HCl的电子式: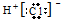 | B. | 氯离子的结构示意图: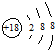 | ||
| C. | 甲烷分子的比例模型: | D. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C |
6.取100mL0.3mol•L-1的H2SO4溶液和300mL0.25mol•L-1的H2SO4溶液配成500mL的溶液所得溶液中H+的物质的量浓度为( )
| A. | 0.265mol•L-1 | B. | 0.525mol•L-1 | C. | 0.21mol•L-1 | D. | 0.42mol•L-1 |
3.A、B、D、E、F、G为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.G与D最外层电子数相等.回答下列问题:
(1)A在周期表中的位置是第一周期第ⅠA族
(2)D、E、G三种元素均可形成简单离子,其半径由大到小的顺序为r(S2-)>r(O2-)>r(Na+)(用离子符号表示)
(3)B、F、G三种元素形成的最高价氧化物对应的水化物中酸性最强的物质是高氯酸(填物质名称); B、D、G三种元素形成的最简单气态氢化物中的沸点最高的物质是H2O(填化学式)
(4)A与B形成的所有化合物中,等质量时耗氧量最大的物质的分子构型为正四面体形
(5)由这些元素组成的物质,其组成和结构信息如下表:
①a的电子式为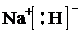 ;
;
②78g b中含有阴离子的物质的量为1mol;
③c的电子式为 ;
;
④单质B与d的浓溶液反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(1)A在周期表中的位置是第一周期第ⅠA族
(2)D、E、G三种元素均可形成简单离子,其半径由大到小的顺序为r(S2-)>r(O2-)>r(Na+)(用离子符号表示)
(3)B、F、G三种元素形成的最高价氧化物对应的水化物中酸性最强的物质是高氯酸(填物质名称); B、D、G三种元素形成的最简单气态氢化物中的沸点最高的物质是H2O(填化学式)
(4)A与B形成的所有化合物中,等质量时耗氧量最大的物质的分子构型为正四面体形
(5)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 仅由A和E两元素组成的离子化合物 |
| b | 由D和E组成的离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 化学组成为A2GD4 |
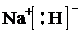 ;
;②78g b中含有阴离子的物质的量为1mol;
③c的电子式为
 ;
;④单质B与d的浓溶液反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
17.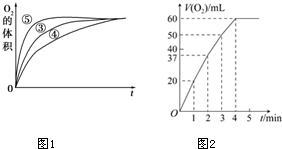 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)写出实验③中H2O2分解反应方程式并标明电子转移的方向和数目: .
.
(2)实验①和②的目的是探究反应物浓度对反应速率的影响.
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论:碱性环境能增大H2O2分解的速率;酸性环境能减小H2O2分解速率.
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因:随着反应的进行,H2O2的浓度减小,反应速率减慢,计算H2O2的初始物质的量浓度为0.11mol/L.(保留两位有效数字,在标准状况下测定)
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分组实验 | 催化剂 | |
| ① | 10mL 5% H2O2溶液 | 无 |
| ② | 10mL 2% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
 .
.(2)实验①和②的目的是探究反应物浓度对反应速率的影响.
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论:碱性环境能增大H2O2分解的速率;酸性环境能减小H2O2分解速率.
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因:随着反应的进行,H2O2的浓度减小,反应速率减慢,计算H2O2的初始物质的量浓度为0.11mol/L.(保留两位有效数字,在标准状况下测定)
18.下列说法正确的是( )
| A. | 用pH试纸测氯水的pH | |
| B. | 用磨口玻璃瓶保存NaOH溶液 | |
| C. | 中和滴定时锥形瓶使用前需用待测液润洗 | |
| D. | 用CS2可除去试管内壁残留的S |
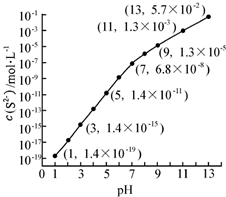 (1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
(1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
 .
.