题目内容
15.在同温同压下,下列各组热化学方程式中△H2>△H1的是( )| A. | 2H2(g)+O2(g)═2H2O(g),△H1; 2H2(g)+O2(g)═2H2O(l),△H2 | |
| B. | S(s)+O2(g)═SO2(g),△H1; S(g)+O2(g)═SO2(g),△H2 | |
| C. | C(s)+$\frac{1}{2}$ O2(g)═CO(g),△H1; C(s)+O2(g)═CO2(g),△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g),△H1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g),△H2 |
分析 A、液态水变为气态水的过程是吸热过程;
B、固体硫变为气态硫需要吸收热量;
C、碳单质完全燃烧放热多于不完全燃烧放的热.
D、化学反应方程式的系数加倍,焓变数值加倍.
解答 解:A、物质的燃烧反应是放热的,所以焓变是负值,液态水变为气态水的过程是吸热的,故△H1>△H2,故A错误;
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1>△H2,故B错误;
C、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反应的焓变是负值,故△H1>△H2,故C错误;
D、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,2△H1=△H2,△H1<△H2,故D正确;
故选D.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
5. 奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
 奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )| 选项 | 蓝 | 黑 | 红 | 黄 | 绿 |
| A | SiO2 | Fe SO4溶液 | O2 | NaOH溶液 | Cu |
| B | O2 | 稀H2SO4 | CO2 | Fe | NaOH溶液 |
| C | O2 | 稀H2SO4 | Al(OH)3 | NH3 | NaOH |
| D | Mg | CO2 | KOH溶液 | Al | Fe2O3 |
| A. | A | B. | B | C. | C | D. | D |
6.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 物质的量浓度为0.5mol•L-1的MgCl2溶液,含有的Cl-数为1NA | |
| B. | 常温常压下,80gSO3含有的氧原子数为3NA | |
| C. | 常温常压下,22.4LH2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
20.下列说法正确的是( )
| A. | 1mol任何物质都约含有6.02×1023个原子 | |
| B. | 物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| C. | O2的摩尔质量是32 | |
| D. | 摩尔是物质的量的单位 |
7.将0.4mol丁烷完全燃烧后生成的气体全部缓慢通人1L 2mol/L NaOH溶液中,生成的 NaHCO3和Na2CO3的物质的量之比为( )
| A. | 3:2 | B. | 3:1 | C. | 2:1 | D. | 2:3 |
4.如下a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物,下列有关说法不正确的是( )
a$→_{一定条件}^{HBr}$b$\stackrel{NaOH溶液}{→}$c$→_{△}^{O_{2}(Cu)}$d$→_{②H+}^{①银氨溶液}$e$→_{浓硫酸△}^{+c}$f.
a$→_{一定条件}^{HBr}$b$\stackrel{NaOH溶液}{→}$c$→_{△}^{O_{2}(Cu)}$d$→_{②H+}^{①银氨溶液}$e$→_{浓硫酸△}^{+c}$f.
| A. | 若a的相对分子质量是42,则d是丙醛 | |
| B. | 若d的相对分子质量是44,则a是乙炔 | |
| C. | 若a为苯乙烯(C6H5-CH=CH2),则f的分子式是C16H16O2 | |
| D. | 若a为单烯烃,则d与f的最简式一定相同 |
3.Ⅰ、实验室里用图1所示的装置制无水CuCl2,根据图示回答下列问题:
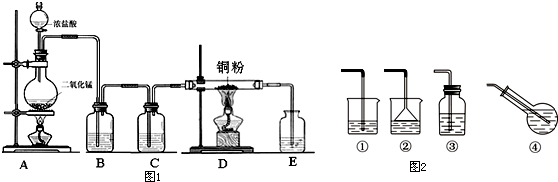
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况: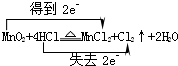 .
.
(2)B瓶盛放的试剂是饱和食盐水(填名称),其作用是除去HCl;C瓶盛放的试剂是浓硫酸(填名称),其作用是干燥Cl2;
(3)实验开始时,应首先检验装置的气密性;实验结束应先熄灭D处的酒精灯;
(4)写出D处管内反应的化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
Ⅱ、(1)若制备饱和氯水,图2吸收装置中最佳的选择是④;
(2)用滴管将新制氯水慢慢滴入含酚酞的NaOH溶液中,当滴到最后一滴时,红色褪去.产生上述现象的可能原因有两种:①氯水显酸性,NaOH溶液被中和而褪色;②氯水中的HClO将酚酞氧化而褪色.请你帮他设计实验证明红色褪去的原因是①还是②.

(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况:
 .
.(2)B瓶盛放的试剂是饱和食盐水(填名称),其作用是除去HCl;C瓶盛放的试剂是浓硫酸(填名称),其作用是干燥Cl2;
(3)实验开始时,应首先检验装置的气密性;实验结束应先熄灭D处的酒精灯;
(4)写出D处管内反应的化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
Ⅱ、(1)若制备饱和氯水,图2吸收装置中最佳的选择是④;
(2)用滴管将新制氯水慢慢滴入含酚酞的NaOH溶液中,当滴到最后一滴时,红色褪去.产生上述现象的可能原因有两种:①氯水显酸性,NaOH溶液被中和而褪色;②氯水中的HClO将酚酞氧化而褪色.请你帮他设计实验证明红色褪去的原因是①还是②.
| 实验操作 | 实验现象 | 结 论 |
| 向已褪色的溶液中加入适量NaOH溶液 | 溶液变红 | 假设①成立 |
| 溶液不变红 | 假设②成立 |
 CH2CH3 B.
CH2CH3 B. 与
与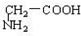 C.
C.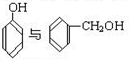 D.CH3CH2C≡CH与CH2=CH-CH=CH2 E.
D.CH3CH2C≡CH与CH2=CH-CH=CH2 E.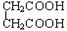 与
与
 乙苯
乙苯 2,3-二甲基戊烷
2,3-二甲基戊烷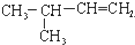 3-甲基-1-丁烯
3-甲基-1-丁烯 .
.