题目内容
7.将0.4mol丁烷完全燃烧后生成的气体全部缓慢通人1L 2mol/L NaOH溶液中,生成的 NaHCO3和Na2CO3的物质的量之比为( )| A. | 3:2 | B. | 3:1 | C. | 2:1 | D. | 2:3 |
分析 根据C原子守恒知,丁烷完全燃烧生成n(CO2)=4n(C4H10)=0.4mol×4=1.6mol,二氧化碳通入1L 2mol/L NaOH溶液中,n(NaOH)=1L×2mol/L=2mol,如果生成NaHCO3,根据C、Na原子关系知需要n(NaOH)=n(CO2)=1.6mol<2mol,如果生成碳酸钠,则n(NaOH)=2n(CO2)=1.6mol×2=3.2mol>2mol,所以生成物有碳酸钠和碳酸氢钠,根据Na、C原子守恒列方程式组计算.
解答 解:根据C原子守恒知,丁烷完全燃烧生成n(CO2)=4n(C4H10)=0.4mol×4=1.6mol,二氧化碳通入1L 2mol/L NaOH溶液中,n(NaOH)=1L×2mol/L=2mol,如果生成NaHCO3,根据C、Na原子关系知需要n(NaOH)=n(CO2)=1.6mol<2mol,如果生成碳酸钠,则n(NaOH)=2n(CO2)=1.6mol×2=3.2mol>2mol,所以生成物有碳酸钠和碳酸氢钠,设生成NaHCO3和Na2CO3的物质的量分别是xmol、ymol,
$\left\{\begin{array}{l}{x+y=1.6}\\{x+2y=2}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=1.2}\\{y=0.4}\end{array}\right.$
则NaHCO3和Na2CO3的物质的量之比=1.2mol:0.4mol=3:1,
故选B.
点评 本题考查化学方程式有关计算,为高频考点,利用原子守恒分析解答即可,注意该题要进行过量计算,为易错题.

练习册系列答案
相关题目
18.下列化学用语表达不正确的是( )
| A. | 图为丙烷的球棍模型: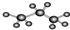 | B. | 丙烯的结构简式为:CH3CHCH2 | ||
| C. | 某有机物的名称是:2,3二甲基戊烷 | D. | 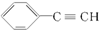 的最简式为:C4H3 的最简式为:C4H3 |
15.在同温同压下,下列各组热化学方程式中△H2>△H1的是( )
| A. | 2H2(g)+O2(g)═2H2O(g),△H1; 2H2(g)+O2(g)═2H2O(l),△H2 | |
| B. | S(s)+O2(g)═SO2(g),△H1; S(g)+O2(g)═SO2(g),△H2 | |
| C. | C(s)+$\frac{1}{2}$ O2(g)═CO(g),△H1; C(s)+O2(g)═CO2(g),△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g),△H1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g),△H2 |
2.下列对进行下列有关判断中,正确的是( )
| A. | 加入足量的CaCl2溶液,产生了白色沉淀,则溶液中一定含有大量的CO32- | |
| B. | NaCl溶液与Na2CO3固体灼烧时火焰颜色相同 | |
| C. | 通过灼热的CuO,能使固体由黑变红的气体一定是H2 | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
12.能将氯化钙、盐酸、氢氧化钾三种溶液鉴别出来的试剂是( )
| A. | 氯化钠溶液 | B. | 苛性钠溶液 | C. | 硝酸银溶液 | D. | 碳酸钠溶液 |
19.用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊 | 饱和Na2CO3溶液 |
| B | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | 澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
16.下列实验现象的描述正确的是( )
| A. | 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 | |
| B. | 铜在氯气中燃烧,产生棕黄色烟,产物溶于水,溶液呈蓝绿色 | |
| C. | 铁丝在氯气中燃烧,产生红色的浓烟,产物溶于水,溶液呈浅绿色 | |
| D. | 钠在空气中燃烧,发出黄色的火焰,生成白色固体 |
15.实验室里用下列药品和仪器来制取纯净的无水氯化铜:
图中A、B、C、D、E、F的虚线部分表示玻璃管接口,接口的弯曲和伸长等部分未画出.根据要求填写下列各小题空白.
(1)如果所制得气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)
③接⑤接④接②接①接⑥;其中,②与④装置相连时,玻璃管接口(用装置中字母表示)应是接C.
(2)装置⑥中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(3)实验开始时,应首先检验装置的气密性;实验结束时,应先熄灭①处的酒精灯.
(4)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O
(5)待充分反应后,装置①的玻璃管中呈棕黄色.冷却后,将制得的产物配成溶液,溶液呈绿(或蓝绿)色.
(6)若反应中有71gCl2生成,则被氧化的HCl的物质的量为2mol,转移电子数为2NA.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 | 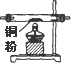 |  |  |  | 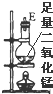 |  |
(1)如果所制得气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)
③接⑤接④接②接①接⑥;其中,②与④装置相连时,玻璃管接口(用装置中字母表示)应是接C.
(2)装置⑥中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(3)实验开始时,应首先检验装置的气密性;实验结束时,应先熄灭①处的酒精灯.
(4)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O
(5)待充分反应后,装置①的玻璃管中呈棕黄色.冷却后,将制得的产物配成溶液,溶液呈绿(或蓝绿)色.
(6)若反应中有71gCl2生成,则被氧化的HCl的物质的量为2mol,转移电子数为2NA.