题目内容
6.设NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 物质的量浓度为0.5mol•L-1的MgCl2溶液,含有的Cl-数为1NA | |
| B. | 常温常压下,80gSO3含有的氧原子数为3NA | |
| C. | 常温常压下,22.4LH2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
分析 A、溶液体积不明确;
B、求出三氧化硫的物质的量,然后根据1mol三氧化硫中含3mol氧原子来分析;
C、常温常压下,体积摩尔体积大于22.4L/mol;
D、标况下,水为液态.
解答 解:A、溶液体积不明确,故溶液中的氯离子的个数无法计算,故A错误;
B、80g三氧化硫的物质的量为1mol,而1mol三氧化硫中含3mol氧原子,即3NA个,故B正确;
C、常温常压下,体积摩尔体积大于22.4L/mol,故22.4L氢气的物质的量小于1mol,故含有的原子个数小于2NA个,故C错误;
D、标况下,水为液态,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.铅丹(Pb304)可作防锈用涂料,已知铅丹中Pb元素的化合价只有+2、+4,且+2价稳定,+4价的Pb具有强氧化性,能氧化浓盐酸生成Cl2.则下列说法不正确的是( )
| A. | Pb304可表示为2Pb0•Pb02 | |
| B. | 可用Pb0在空气中加热制备铅丹,其n(氧化剂):n(还原剂)=1:6 | |
| C. | 0.1mol Pb304与足量的浓盐酸反应,生成Cl20.1 mol | |
| D. | amolPb304加强热分解生成Pb0,则加热过程中转移电子数为2a NA |
1.下列离子方程式或热化学方程式正确的是( )
| A. | 在不同温度下,以相同浓度相同体积的Na2S2O3与H2SO4反应来探究温度对化学反应速率的影响:3S2O32-+2SO42+10H+═6SO2↑+2S↓+5H2O | |
| B. | 酸性条件下,KI被O2氧化的离子方程式:4I-+O2+4H+═2I2+2H2O | |
| C. | 已知25℃、101kPa时,1molH2与溴蒸气完全反应生成气态HBr放出能量Q kJ,其热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=-2Q kJ•mol-1 | |
| D. | 表示中和热的热化学方程式:2HCl(aq)+Ba(OH)2(aq)═BaCl2(aq)+2H2O(l)△H=-114.6 |
11.下列说法中错误的是( )
| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | [Cu(H2O)4]2+中Cu提供空轨道,H2O中O提供孤对电子形成配位键 | |
| C. | 元素电负性越大的原子,吸引电子的能力越强 | |
| D. | 电离能越大,表示气态时该原子越易失电子 |
18.下列化学用语表达不正确的是( )
| A. | 图为丙烷的球棍模型: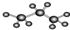 | B. | 丙烯的结构简式为:CH3CHCH2 | ||
| C. | 某有机物的名称是:2,3二甲基戊烷 | D. |  的最简式为:C4H3 的最简式为:C4H3 |
15.在同温同压下,下列各组热化学方程式中△H2>△H1的是( )
| A. | 2H2(g)+O2(g)═2H2O(g),△H1; 2H2(g)+O2(g)═2H2O(l),△H2 | |
| B. | S(s)+O2(g)═SO2(g),△H1; S(g)+O2(g)═SO2(g),△H2 | |
| C. | C(s)+$\frac{1}{2}$ O2(g)═CO(g),△H1; C(s)+O2(g)═CO2(g),△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g),△H1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g),△H2 |
16.下列实验现象的描述正确的是( )
| A. | 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 | |
| B. | 铜在氯气中燃烧,产生棕黄色烟,产物溶于水,溶液呈蓝绿色 | |
| C. | 铁丝在氯气中燃烧,产生红色的浓烟,产物溶于水,溶液呈浅绿色 | |
| D. | 钠在空气中燃烧,发出黄色的火焰,生成白色固体 |