题目内容
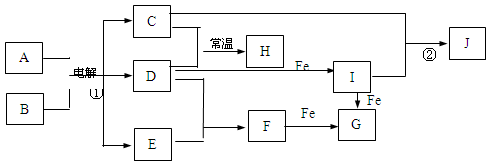
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: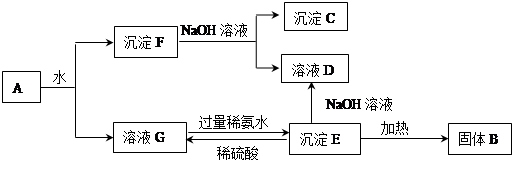
据此回答下列问题:
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D 三种物质的化学式为:B_________ C_________ D_________
(3)沉淀E与稀硫酸反应的离子方程式为________________________________________。
(4)将沉淀F中存在的两种金属元素组成的合金溶于100 mL 4mol/LHCl溶液中,然后再滴加1 mol/L NaOH溶液,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。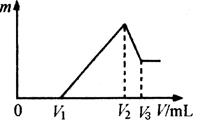
已知V1=160mL。根据以上信息回答:
①_________(填“能”或“不能”)计算出V3
②V2为_________mL(若能算出具体数字,请在横线上填写具体数字;若不能请在横线上填“不能确定”)
(1)过滤(2分)
(2)Al2O3 (2分)Fe2O3 (2分) NaAlO 2(2分)
(3)Al(OH)3+3H+=Al3++3H2O(2分)
(4)①不能(2分) ②400(2分)
解析试题分析:已知混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,加水溶解后,沉淀F 是Al2O3和Fe2O3;溶液G是KAl(SO4)2溶液,其中含有K+、Al3+、SO42—
(1)分离溶液与沉淀的方法是过滤。
(2)沉淀F 是Al2O3和Fe2O3,加入过量NaOH溶液,沉淀C是Fe2O3,溶液D是NaAlO 2溶液。溶液G是KAl(SO4)2溶液与稀氨水反应生成E,Al(OH)3沉淀;Al(OH)3加热得到B,Al2O3。
(3)沉淀E与稀硫酸反应的离子方程式Al(OH)3+3H+=Al3++3H2O;
(4)沉淀F中存在的两种金属元素是Al和Fe,因为不知二者的物质的量无法计算出V3。100 mL 4mol/LHCl溶解Al和Fe后,用1 mol/L NaOH沉淀,由图像知,
V2时Al和Fe 的存在形式是:Al(OH)3、Fe(OH)3,可以认为此点是氢氧化钠和盐酸完全反应,所以V2为400mL.
考点:Al和Fe的化合物的性质分析和推断。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
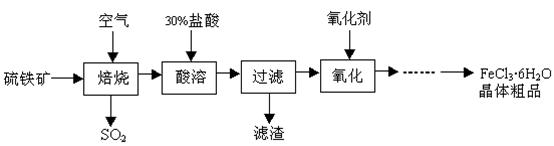
轻巧夺冠周测月考直通名校系列答案工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: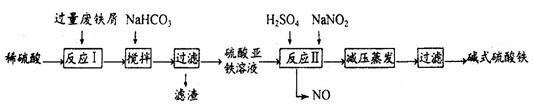
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应I溶液中存在的金属阳离子有__________________。
(2)加入NaHCO3的目的是调节pH,使溶液中的______(填“Fe3+”、“Fe2+”或“A13+”)沉淀。该工艺流程中“搅拌”的作用是_____________。
(3)反应II的离子方程式为__________。在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为________。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为__________。
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为__________________________。
目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。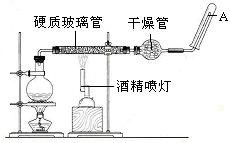
请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式: ;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
| | ① | ② | ③ | ④ |
| 溶液中的金属离子 | | Fe2+ | | |
| 残留固体成分 | Fe、Pt | | Pt | Pt |
②当x="0.5" ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a = ,b = ,
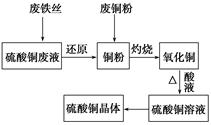
氯化铜是一种广泛用于生产颜料、用木材防腐剂的化工产品。某研究性学习小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体。
(1)固体A用稀盐酸溶解而不用水溶解的原因是________。
(2)加试剂X用于调节pH以除去杂质,X可选用下列试剂中的____(填序号)。
| A.NaOH | B.NH3.H2O | C.CuO | D.Cu(OH)2E. CuSO4 |
(4)实验室采用如下图所示装置,可使粗铜与Cl2反应转化为固体A(部分加热仪器和夹持装置已略去)。
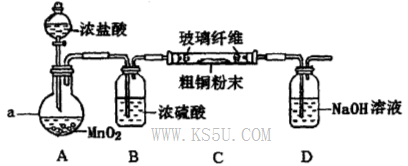
①该装置中仪器a的名称是____,其中发生反应的离子方程式是____________。
②有同学认为应在浓硫酸洗气瓶前增加吸收HCI的装置,你认为是否必要?____________(填“是”或“否”)。
③该装置存在一定的安全隐患,消除该安全隐患的措施是_______________________。