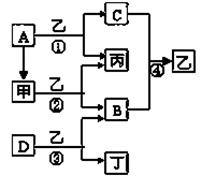
��Ŀ����
Ŀǰ������ʹ����㷺�Ľ���֮һ����֪�ڸ����£�Fe��ˮ�����ɷ�����Ӧ��
Ӧ������װ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ����¡�Fe��ˮ�����ķ�Ӧʵ�顱��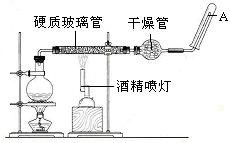
��ش����е����⡣
�������ڱ��е�λ����_______
��д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��3���������������������ﷴӦԭ�������Ӹֹ죬�÷�Ӧ�Ļ�ѧ����ʽΪ
��4���������Ͳ���ɵĺϽ�a mol������Pt�����ʵ�������Ϊx���гɷ�ĩ״��ȫ��Ͷ�뺬bmol HNO3��ϡ��Һ�У�ʹ���ַ�Ӧ����HNO3�Ļ�ԭ����ֻ��NO���Իش��������⣺
����HNO3���������ӣ���Һ�еĽ������ӺͲ�������ijɷ�����������������������ӷ�����д�±��հף�
| | �� | �� | �� | �� |
| ��Һ�еĽ������� | | Fe2+ | | |
| ��������ɷ� | Fe��Pt | | Pt | Pt |
�ڵ�x="0.5" ������Һ��Fe3+��Fe2+�����ʵ�����ȣ��ڱ�״���¹�����112mLNO��
��a = ��b = ��
��1���������ڣ��ڢ� �� (1��)
��2��3Fe+4H2O(g) Fe3O4+4H2 (2��)
Fe3O4+4H2 (2��)
��3��2Al+Fe2O 3 Al2O3 + 2Fe (2��) (�𰸺���������)
Al2O3 + 2Fe (2��) (�𰸺���������)
��4����(2��)
��a =0.012��b = 0.02 (2��) �� �� �� �� ��Һ�еĽ������� Fe2+ Fe2+ Fe2+ Fe3+ Fe3+ ��������ɷ� Fe��Pt Pt Pt Pt
���������������1��Fe��Ԫ�����ڱ���λ�ڵ������ڣ��ڢ� �塣
��2��Fe��H2O��g����Ӧ����Fe3O4��H2����ѧ����ʽΪ��3Fe+4H2O(g)  Fe3O4+4H2
Fe3O4+4H2
��3���������������ﷴӦԭ�������Ӹֹ죬��ѧ����ʽΪ��2Al+Fe2O 3 Al2O3 + 2Fe
Al2O3 + 2Fe
��4������Ϊ��Feʣ�࣬������Һ����Fe2+������HNO3�����࣬Feȫ����Ӧ������ֻ��Pt��������HNO3������Fe2+������ΪFe3+����Һ����Fe2+��Fe3+��HNO3�ﵽ������ȫ��ת��ΪFe3+��
����Һ��Fe3+��Fe2+�����ʵ�����ȣ���Fe2+�����ʵ���Ϊnmol����Fe3+ҲΪnmol������������ԭ��Ӧ�����غ��֪��2n+3n=0.112L��22.4L/mol��3����n=0.003mol��Fe2+��Fe3+��Ϊ0.003mol��Pt�����ʵ�������Ϊx=0.5����Pt�����ʵ���Ϊ0.006mol������a=0.003mol+0.003mol+0.006mol=0.012mol��HNO3��Ӧ��ת��ΪFe(NO3)2��Fe(NO3)3��NO������HNO3�����ʵ���b=0.003mol��2+0.003mol��3+0.112L��22.4L/mol=0.02mol��
���㣺���⿼�����ʵ����ʡ�Ԫ�����ڱ�����ѧ���㡣

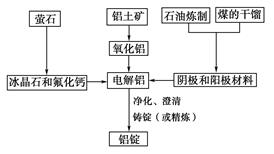
�ú���A12O3��SiO2������FeO·xFe2O3�������Ʊ�A12(SO4)3·18H2O����������������(���ֲ�����������):
��.�������м������ϡH2SO4������;
��.����Һ�м������KMnO4��Һ��������Һ��pHԼΪ3��
��.���ȣ�����������ɫ���������ã��ϲ���Һ���Ϻ�ɫ;
��.����MnSO4���Ϻ�ɫ��ʧ�����ˣ�
��.Ũ�����ᾧ�����룬�õ���Ʒ��
H2SO4�ܽ�A12O3�����ӷ���ʽ��
��KMnO4 ����Fe2+�����ӷ���ʽ���������� MnO4-+��Fe2++�� =
MnO4-+��Fe2++�� = Mn2++��Fe3+ +��
Mn2++��Fe3+ +��
��ʽ���������� ,���������� ��
��3����֪�������������������pH ks5u
| | Al��OH��3 | Fe��OH��2 | Fe��OH��3 |
| ��ʼ����ʱ | 3.4 | 6.3 | 1.5 |
| ��ȫ����ʱ | 4.7 | 8.3 | 2.8 |
���ݱ������ݽ��Ͳ�����Ŀ�ģ� ��
��֪:һ�������£�MnO4 - ����Mn2+��Ӧ����MnO2��
�� �� �� �ij����м���ŨHCI�����ȣ���˵�������д���MnO2�������� ��
�ڢ� �м���MnSO4��Ŀ���� ��
���Ρ��������ڹ�ũҵ�����������ˮ�����ȷ������ż���㷺��Ӧ�á�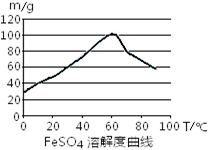
��1������м��ϡ���ᷴӦ�Ʊ�FeSO4
���Ʊ�ԭ�������ӷ���ʽ��ʾΪ ����Ҫ���FeSO4�������ʣ���ȡ���д�ʩ����ȷ���� ��
A��ʹ��Ũ��������м��Ӧ
B��ʹ��ĥϸ�����۷�Ӧ
C�������¶���50��70��
D�������¶���80��100��
����������Ӧ�����У�������淢����Ӧ��4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
��Ҫ���ٲ�ƷFeSO4��Fe3+�ĺ�������ȡ���д�ʩ����ȷ���� ��
A������ϡ�����Ũ�Ȳ���̫��
B����ȥO2����ˮע��Ũ�������Ʒ�Ӧ�����ϡ����
C����Ӧ�б���n(Fe)/n(H2SO4) >1
D����Ӧ��Ӧ��������Fe2��SO4��3����
�۷�Ӧ��������Һ���� ����ȴ�����ˡ�ϴ�Ӽ���FeSO4��7H2O���塣
��2����ҵ���ú�������Cu��Al�ķ���м�Ʊ�Fe2��SO4��3
�䷴Ӧ�������������£�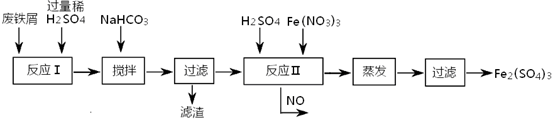
�ټ���NaHCO3�����裬�����ҺpH������ ��Χ�ڣ�ʹ���ʳ������˳�ȥ��
| ������ | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| ��ʼ���� | 2.3 | 7.5 | 3.4 | 4.7 |
| ��ȫ���� | 3.2 | 9.7 | 4.4 | 6.7 |
�ڷ�Ӧ���з�Ӧ�����ӷ���ʽ�ǣ� ��
�������У�����Ӧ�������NO���һ������X����Ϻ�����ͨ�뷴Ӧ���У�����Ƶ�Ŀ���� ������X��NO��ȵı����� ��
��3����Fe2��SO4��3������S2-��ˮʱ���к�ɫ����������ɫ������������䷴Ӧ�����ӷ���ʽ�� ��
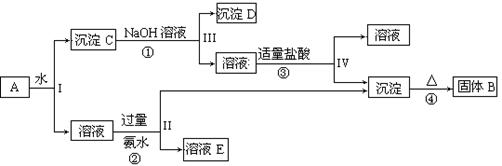

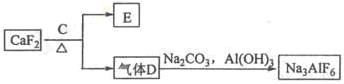
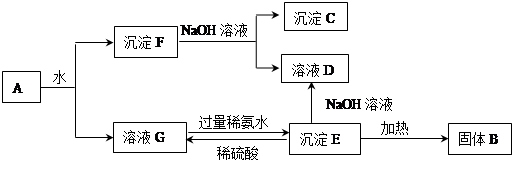
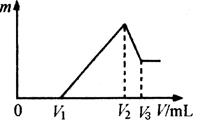
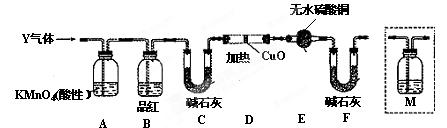
 ��Ԥ��ʵ������Ӧ�� ��
��Ԥ��ʵ������Ӧ�� ��