��Ŀ����
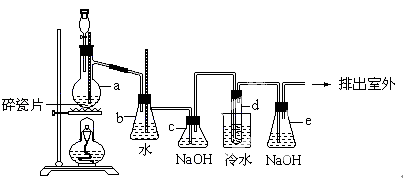
����Ŀ����ҵ��������淋���������ͼ��ʾ��
��1������淋�ˮ��Һ��(����ԡ��������ԡ����ԡ�)����ˮ��Һ�и����ӵ�Ũ�ȴ�С˳��Ϊ����
��2����֪N2(g)+3H2(g) ![]() 2NH3(g) ��H<0������Ӧ���а�n(N2)��n(H2)=1��3Ͷ�ϣ��ֱ���200�桢400�桢600���´ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯��������ͼ��
2NH3(g) ��H<0������Ӧ���а�n(N2)��n(H2)=1��3Ͷ�ϣ��ֱ���200�桢400�桢600���´ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯��������ͼ��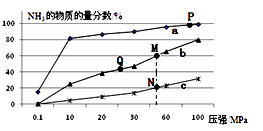
������a��Ӧ���¶�����
�ڹ��ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ������
A����ʱ�����NH3�������H2��ƽ��ת����
B��P��ԭ������ƽ��ת���ʽӽ�100%���ǵ�ǰ��ҵ���������в��õ��¶ȡ�ѹǿ����
C����ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ��K(M)=K(Q)��K(N)
D�����N��ʱc(NH3)��0.2 mol��L��1 �� N��Ļ�ѧƽ�ⳣ��K��0.93
��3�����أ�H2NCONH2����һ�ַdz���Ҫ�ĸ�Ч���ʣ���ҵ����NH3��CO2Ϊԭ���������أ��÷�Ӧʵ��Ϊ������Ӧ��
��һ����2NH3(g)��CO2(g)=H2NCOONH4(s) ��H=��272 kJ��mol��1
�ڶ�����H2NCOONH4(s)=CO(NH2)2(s)��H2O(g) ��H=��138 kJ��mol��1
д����ҵ����NH3��CO2Ϊԭ�Ϻϳ����ص��Ȼ�ѧ����ʽ��
��4��ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ0.5 L�ܱ�������Ͷ��4 mol����1mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯������ͼ��ʾ��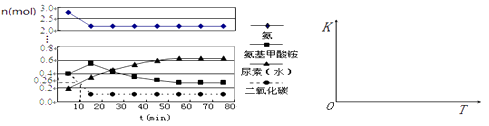
����֪�ܷ�Ӧ�Ŀ���������һ����������ϳ������ܷ�Ӧ�Ŀ����ɵ�����Ӧ�������ܷ�Ӧ���е�minʱ����ƽ�⡣
�ڷ�Ӧ���е�10 minʱ���CO2�����ʵ�����ͼ��ʾ������CO2��ʾ�ĵ�һ����Ӧ������v(CO2)�� ��
����������ͼ�л����ڶ�����Ӧ��ƽ�ⳣ��K���¶ȵı仯��ʾ��ͼ ��
���𰸡�
��1�����ԣ�c(NO3��)>c(NH4+)>c(H+)>c(OH��)
��2��200�棻ACD
��3��2NH3(g)��CO2(g) ![]() H2O(g)��CO(NH2)2 (s) ��H=��134kJ/mol
H2O(g)��CO(NH2)2 (s) ��H=��134kJ/mol
��4������55��0.148 mol/(L��min)��
����������1���������ǿ�������Σ�����ˮ��Һ�����ԣ�NH4�� �ܷ���ˮ�ⷴӦ������NH4 Ũ�Ƚ��ͣ���ˮ��Һ�и����ӵ�Ũ�ȴ�С˳��Ϊc(NO3��)>c(NH4+)>c(H+)>c(OH��)��
��2���ٹ�ҵ�ϳɰ��Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ������������ʵ���������С������ͼ������a��Ӧ���¶���200�档��A����ʱ�����NH3 �� ƽ�������ƶ����������H2��ƽ��ת���ʣ���ȷ��B.P��ԭ������ƽ��ת������Ȼ�ӽ�100%�������豸��Ҫ��ܸߣ���ǰ��ҵ���������������������������¶Ⱥ�ѹǿ��B�����C.��ͼ��M��Q���¶���ͬ����K(M)=K(Q)��N���¶Ƚϸߣ��Է��ȷ�Ӧ���ԣ��¶�Խ�ߣ�KֵԽС����ƽ�ⳣ��K�Ĵ�С��ϵ��K(M)=K(Q)��K(N)����ȷ��D�����N��ʱc(NH3)��0.2 mol��L��1 �� ��ʱ�������ʵ�������Ϊ20%�������������Ũ��Ϊ1mol/L��������������Ũ�ȷֱ�Ϊ0.2mol/L��0.6mol/L����N��Ļ�ѧƽ�ⳣ��K�֣�0.2��0.2���£�0.2��0.6��0.6��0.6��=0.93��D����ȷ����ѡACD��
��3�����ݸ�˹���ɣ���2NH3(g)��CO2(g)=H2NCOONH4(s) ��H=��272 kJ��mol��1����H2NCOONH4(s)= CO(NH2)2(s)��H2O(g) ��H=��138 kJ��mol��1 �� ����+�ڿɵ���NH3��CO2Ϊԭ�Ϻϳ����ص��Ȼ�ѧ����ʽΪ2NH3(g)��CO2(g) ![]() H2O(g)��CO(NH2)2 (s) ��H=��134kJ/mol��
H2O(g)��CO(NH2)2 (s) ��H=��134kJ/mol��
��4������ͼ���֪��15�������ң������Ͷ�����̼��Ӧ���ɰ�������狀��ٱ仯�������ǵ�һ����Ӧ������������������ټ�С���ﵽƽ�⣬�������ǵڶ�����Ӧ��������б�ʲ��ѿ����ڶ�����Ӧ�����������ܷ�Ӧ�Ŀ���������һ����������ϳ������ܷ�Ӧ�Ŀ����ɵڶ�������������ͼ��֪��������55����ʱ�����ʵ������ٱ仯������Ӧ��55����ʱ�ﵽƽ�⡣�ڷ�Ӧ���е�10minʱ�����CO2�����ʵ���Ϊ0.26mol��������̼��Ũ�ȱ仯Ϊc(CO2)=(1mol-0.26 mol)��0.5L=1.48mol/L������CO2��ʾ��һ����Ӧ����v (CO2)=1.48mol/L��10min=0.148 mol/(L��min)���۵ڶ�����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���ƽ�ⳣ���������Եڶ�����Ӧ��ƽ�ⳣ��K���¶ȵı仯��ʾ��ͼΪ��  ����1���������ǿ�������Σ�ˮ������ԣ����笠����ӵ�ˮ�������Һ������Ũ�ȵĴ�С��ϵ��
����1���������ǿ�������Σ�ˮ������ԣ����笠����ӵ�ˮ�������Һ������Ũ�ȵĴ�С��ϵ��
��2���ٸ����¶ȶԻ�ѧƽ���Ӱ������жϣ�
�ڸ��ݻ�ѧƽ���Ӱ�����غ�ƽ�������з������ɣ�
��3�����ݸ�˹���ɼ��㷴Ӧ�ȣ�Ȼ����д�Ȼ�ѧ����ʽ��
��4������ƽ��״̬���ص��ж��Ƿ�ﵽƽ��״̬������ƽ�ⳣ�����¶ȵĹ�ϵ���з���������ͼ��

 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�����Ŀ�����������Fe��ȥ��ˮ���е������Σ�NO3�����ѳ�Ϊ�������о����ȵ�֮һ��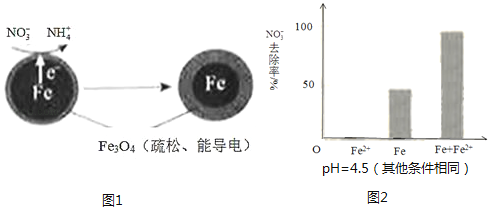
��1��Fe��ԭˮ����NO3���ķ�Ӧԭ����ͼ1��ʾ��
���������������� ��
�������ĵ缫��Ӧʽ�� ��
��2������������Ͷ��ˮ���У���24Сʱ�ⶨNO3����ȥ���ʺ�pH��������£�
��ʼpH | pH=2.5 | pH=4.5 |
NO3����ȥ���� | �ӽ�100% | ��50% |
24СʱpH | �ӽ����� | �ӽ����� |
��������������̬ |
|
|
pH=4.5ʱ��NO3����ȥ���ʵͣ���ԭ���� ��
��3��ʵ�鷢�֣��ڳ�ʼpH=4.5��ˮ����Ͷ���������۵�ͬʱ������һ������Fe2+�����������NO3����ȥ���ʣ���Fe2+������������ּ��裺
��Fe2+ֱ�ӻ�ԭNO3����
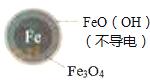
��Fe2+�ƻ�FeO��OH�������㣮
�����Ա�ʵ�飬�����ͼ2��ʾ���ɵõ��Ľ����� ��
��ͬλ��ʾ�ٷ�֤ʵFe2+����FeO��OH����Ӧ����Fe3O4 �� ��ϸ÷�Ӧ�����ӷ���ʽ�����ͼ���Fe2+���NO3��ȥ���ʵ�ԭ�� ��
��4�����������루2����ͬ����1Сʱ�ⶨNO3����ȥ���ʺ�pH����������
��ʼpH | pH=2.5 | pH=4.5 |
NO3����ȥ���� | Լ10% | Լ3% |
1СʱpH | �ӽ����� | �ӽ����� |
�루2�������ݶԱȣ����ͣ�2���г�ʼpH��ͬʱ��NO3��ȥ���ʺ���������������̬��ͬ��ԭ�� ��