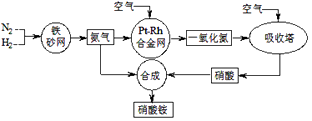
��Ŀ����
����Ŀ����ij������Һ��ͨ��������������������������������Һ��ͨ�����CO2 �� ����������ɫ������
��1��д�������ĵ���ʽ��
��2����������Һ��һ�������ܺ������������������ţ���
A.Cl��
B.Fe2+
C.SiO32��
D.AlO2��
��3��д��һ��ͨ�����CO2ʱ���ɰ�ɫ���������ӷ���ʽ��
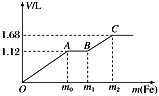
��4����ƹ�ҵ�����������������ж���ˮ�������ϸ�����ſ����ŷţ�ij�ָ�Ũ���ж��ĺ�A���ӣ������ӣ���ˮ���ŷ�ǰ�Ĵ����������£�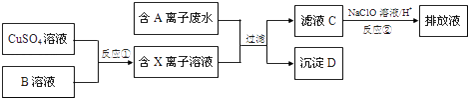
��֪��9.0g����D�����������պ���8.0g��ɫ���壬��Ӧ�������ͨ����������ʯ��ˮʱ������10.0g��ɫ���������õ��Ļ�������ȥ������ʣ�������ܶ�Ϊ1.25g/L������1.12L��
����D�Ļ�ѧʽ����
��5��д������D�����������շ����Ļ�ѧ����ʽ��
��6����ҺC�л���������A���ӣ�ͨ����Ӧ�ڣ��ɽ���ת��Ϊ�Ի����������ʣ��������ӷ���ʽ��ʾ��ԭ����
��7����Ӧ��Ϊ�Ƶ�ij��Ԫ�صĵͼ�X���ӣ���������ԭ��Ӧ�ĽǶȷ���������ܡ����ܡ���Na2SO3��Һ������B��Һ��ԭ������
��8�����ʵ��֤������Na2SO3��Һ�Ƿ������
���𰸡�
��1��![]()
��2��B
��3��CO2+AlO2��+2H2O=Al��OH��3��+HCO3��
��4��CuCN
��5��2CuCN+3O2 ![]() 2CuO+N2+2CO2
2CuO+N2+2CO2
��6��2CN��+5ClO��+2H+=5Cl��+N2��+2CO2��+H2O
��7���ܣ���ΪNa2SO3���л�ԭ�ԣ��п��ܽ�Cu2+��ԭΪCu+���ӣ��������������𰸣�
��8��ȡ����Na2SO3��Һ���Թ��У���������ϡ���ᣬ�ټ����Ȼ�����Һ�����г������ɣ�˵��Na2SO3��Һ���ʣ�����˵��Na2SO3��Һδ���ʡ�
����������1�������ǹ��ۻ��������ʽΪ ![]() ��
��
��2��A��Cl���Է�Ӧ��Ӱ�죬���ܴ��ڣ�B������Fe2+����Һ��ͨ���������������ɳ�����B�����ܴ��ڣ�C������SiO32������Һ��ͨ�백����������������ͨ�����CO2 �� ���ɹ�����������ܣ�D������AlO2������Һ��ͨ�백����������������ͨ�����CO2 �� ���������������������ܣ���ѡB��
��3�����ݣ�2���ķ�������ɫ���������ǹ��������������������Ӧ�����ӷ���ʽΪCO2+AlO2��+2H2O=Al��OH��3��+HCO3����2CO2+SiO32��+2H2O=H2SiO3��+2HCO3����
��4����������ͼ������D�к���CuԪ�أ�8.0g��ɫ����Ϊ0.1molCuO������Cu 6.4g�����ɵ�����ͨ����������ʯ��ˮ������10.0g��ɫ������˵����ɫ������̼��ƣ�����0.1molCO2 �� C������Ϊ1.2g��ʣ��������ܶ�Ϊ1.25g/L��˵����Է�������Ϊ1.25g/L��22.4L/mol=28g/mol���������Ӧ��ΪN2 �� N2�����Ϊ1.12L�����ʵ���Ϊ0.05mol������N1.4g����Ϊ6.4g+1.2g+1.4g=9.0g����ʾ������ֻ��������Ԫ�أ������ʵ���Ϊ1:1:1����˳���D�Ļ�ѧʽΪCuCN��
��5�����ݣ�2���ķ�����CuCN����������������CuO ��CO2 ��N2����Ӧ�ķ���ʽΪ2CuCN+3O2 ![]() 2CuO+2CO2+N2��
2CuO+2CO2+N2��
��6������D�Ļ�ѧʽΪCuCN��˵��A����ΪCN- �� NaClO��Һ���������ԣ���CN����������CO2 ��N2 �� ��������ԭΪ�Ȼ��ƣ���Ӧ�����ӷ���ʽΪ2CN��+5ClO��+2H��=5Cl��+2CO2��+N2��+H2O��
��7����Ӧ��Ϊ�Ƶ�ij��Ԫ�صĵͼ�X����ΪCu+ �� ������Cu2+�������ԣ�Na2SO3��S��+4�ۣ����н�ǿ�Ļ�ԭ�ԣ�������Na2SO3 ��Һ������B��Һ��Na2SO3 ��Һ������ʣ������������ƣ�ֻҪ�����Ƿ�����������Ӽ��ɣ����Է���Ϊȡ����Na2SO3��Һ���ȼ���BaCl2��Һ���ټ�������ϡ���ᣬ�۲������������У�˵��Na2SO3��Һ�ѱ��ʡ�

 �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�