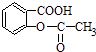��Ŀ����
����Ŀ����.��������Ҫ������Դ�����Ŀ����������Ӧ�ã��ǵ�ǰ���ǹ�ע���ȵ�֮һ��
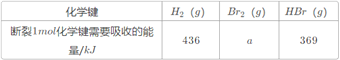
(1)�������ܵķ���֮һ�Ƿֽ�ˮ����������������������_______����ܡ����ܡ�������ˮ�ֽ����������������
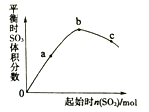
(2)�ø�ѹ��������������������ȼ�ϵ��������Դ���õ�һ����Ҫ��ʽ��ij����ȼ�ϵ�ص������缫�ļ��Ա�־ģ�����壬С��������ͼ��ʾװ�ý���ʵ���жϡ�

�ٸ��ݹ۲쵽�������жϵ缫a(��b)���ԣ���ʯī1���渲��һ���ɫ���壬��a�缫��_____����,
��д��U���������ĵ缫��Ӧʽ��______________������________��Ӧ���������������ԭ���������һ��ʱ�������������6.4g�������·��ͨ���ĵ��ӵ����ʵ�����________mol�����õ�ⷴӦ����ĵ���ȫ��������ȼ�ϵ���ṩ����������Ҫ����__________ L��������״���£�����������Ҫ��
��.������ʻ��ijЩ�������������̣�����������ŷų�NOx��CO��SO2���к����塣
(1)NOx�Ի�������ҪӰ����___________������ĸ��ţ���
A������������ B������ЧӦ C�� �ƻ������� D�� �⻯ѧ����
(2)Ϊ�˼������Ͳ��ͳ��ŷ�NOx����β������װ�����Զ������������Һ��һ����������ת��ΪNH3��NH3����NOx��Ӧ������������Ⱦ�����ʡ�����NH3��NO2��һ�������·�Ӧ�Ļ�ѧ����ʽΪ_________��
(3)ͨ��CO�������ɼ��CO�ĺ������乤��ԭ��Ϊ2CO+O2=2CO2��ʾ��ͼ���£�

��ͨ��CO��һ��Ϊ_______�����������������������������������Һ��H+����_____�����A����B������
��д��B�缫�ĵ缫��Ӧʽ��_____________��
���𰸡����� �� 2C1--2e-=Cl2�� ���� 0.2 2.24 ACD 8NH3+6NO2![]() 7N2+12H2O �� A CO-2e-+H2O=CO2+2H+
7N2+12H2O �� A CO-2e-+H2O=CO2+2H+
��������
I.��1������ֻ�ܽ��ͷ�Ӧ�Ļ�ܣ����ܸı���H��
��2����ʯī1���渲��һ���ɫ���壬ʯī1�ĵ缫��ӦʽΪCu2++2e-=Cu��ʯī1Ϊ��������a�缫Ϊ������
�����ݷŵ�˳��д���ʱ�缫��Ӧʽ�����ݵ����غ�͵缫��Ӧʽ���㡣
II.��1��NOx�Ի�����Ӱ���������������ꡢ�ƻ�O3�㡢�⻯ѧ������
��2��NH3��NOx��Ӧ������������Ⱦ�����ʣ�����ԭ���غ㣬����N2��H2O��
��3�����ݹ���ԭ��2CO+O2=2CO2��CO����ʧ���ӵ�������Ӧ��O2�����õ��ӵĻ�ԭ��Ӧ�����ԭ��صĹ���ԭ����������
��1������ֻ�ܽ��ͷ�Ӧ�Ļ�ܣ����ܸı���H�������������������������ܽ���ˮ�ֽ����������������
��2����ʯī1���渲��һ���ɫ���壬ʯī1�ĵ缫��ӦʽΪCu2++2e-=Cu��ʯī1Ϊ����������������ȼ�ϵ�صĸ�����������a�缫Ϊ������
������Cl-�ŵ���������OH-��U���������ĵ缫��ӦʽΪ2Cl--2e-=Cl2������������������������Ӧ����������n��Cu��=![]() =0.1mol�������缫��ӦʽΪCu2++2e-=Cu�����·��ͨ���������ʵ���Ϊ0.1mol
=0.1mol�������缫��ӦʽΪCu2++2e-=Cu�����·��ͨ���������ʵ���Ϊ0.1mol![]() 2=0.2mol��H2���븺����Ӧ��1molH2ʧȥ2mol���������õ�ⷴӦ����ĵ���ȫ��������ȼ�ϵ���ṩ����������H2���ʵ���Ϊ0.1mol���ڱ�״����H2�����Ϊ0.1mol
2=0.2mol��H2���븺����Ӧ��1molH2ʧȥ2mol���������õ�ⷴӦ����ĵ���ȫ��������ȼ�ϵ���ṩ����������H2���ʵ���Ϊ0.1mol���ڱ�״����H2�����Ϊ0.1mol![]() 22.4L/mol=2.24L��
22.4L/mol=2.24L��
II. ��1��NOx�Ի�����Ӱ���������������ꡢ�ƻ�O3�㡢�⻯ѧ��������ѡACD��
��2��NH3��NOx��Ӧ������������Ⱦ�����ʣ�����ԭ���غ㣬����N2��H2O��NH3��NO2��һ�������·�Ӧ�Ļ�ѧ����ʽΪ8NH3+6NO2![]() 7N2+12H2O��
7N2+12H2O��
��3�����ݹ���ԭ��2CO+O2=2CO2������CO����ʧ���ӵ�������Ӧ��O2�����õ��ӵĻ�ԭ��Ӧ��
��ԭ����и�������ʧ���ӵ�������Ӧ������������������ͨ��CO��һ��Ϊ������B��Ϊ������ͨ��O2��һ��Ϊ������A��Ϊ��������Һ��H+����A����
��B�缫Ϊ������1molCOʧȥ2mol��������1molCO2��������Ե������Һ�Լ�ԭ���غ㣬B�缫�ĵ缫��ӦʽΪCO-2e-+H2O=CO2+2H+��

����Ŀ�������������Ҫ��ѧ��˼�룬���и�����֪����������ȷ���ǣ� ��
ѡ�� | ��֪ | ������� |
A |
|
|
B |
|
|
C | �����£�Ũ����ʹ���ۻ� | Ũ������ͭ����Ӧ |
D |
| ���� |
A. A B. B C. C D. D
����Ŀ������A��B��C��D�����л����ʵ������Ϣ��
A | B | C | D | E |
����ʹ������Ȼ�̼��Һ��ɫ�� | ����C��H����Ԫ����ɣ� | ����C��H��O����Ԫ����ɣ� | ����Է���������C��2�� | ����C��H��O����Ԫ����ɣ� |
��1��A�����������ӳɷ�Ӧ�����ɷ���F��F�ڷ�����ɺͽṹ�����Ƶ��л�����һ���ࣨ�׳ơ�ͬϵ��������Ǿ�����ͨʽCnH2n+2 �� ��n=ʱ�������л��↑ʼ����ͬ���칹�壮
��2��A��������Ȼ�̼��Һ��Ӧ��������Ľṹ��ʽ������������һ�������¿�������ȡ��Ķ�Ԫ������ʽΪ�� ��
��3��B���е�������������ţ�������ɫ��ζҺ�塢���ж����۲�����ˮ�����ܶȱ�ˮ��������KMnO4��Һ����ˮ��Ӧ��ɫ�����κ������²���������Ӧ��д���ڴ��������£�B���巴Ӧ�Ļ�ѧ����ʽ�� ��
��4��C��E��Ӧ�����������÷�Ӧ����Ϊ���仯ѧ��Ӧ����ʽΪ�� ��
��5��D��һ���������ܷ���������Ӧ���仯ѧ��Ӧ����ʽ�� ��