��Ŀ����
����Ŀ��������ѧ֪ʶ�ش�
��1�����������ҹ�����Ѹ�ͷ�չ��Ϊ���ǵij��д��������������������·�Ӧ�������죺 8Al+3Fe3O4 ![]() 4Al2O3+9Fe���÷�Ӧ��������ȡ������ȡ�����Ӧ����Ӧ�еĻ�ԭ�������ѧʽ����
4Al2O3+9Fe���÷�Ӧ��������ȡ������ȡ�����Ӧ����Ӧ�еĻ�ԭ�������ѧʽ����
��2����Ԫ����NaCl��Na2O2��NaHCO3��Na2SiO3�ȶ�����Ҫ�Ļ�������������ѡ���ƵĻ�����Ļ�ѧʽ��գ����г�������ΪDZˮͧ�ͺ��������������Դ�ĵ���ɫ������ �� ���������Ƹ�㣬Ҳ����������ҩ���� ��
��3����FeCl2��Һ��ͨ��Cl2 �� ��Ӧ�����ӷ���ʽΪ2Fe2++Cl2=2Fe3++2Cl�� �� ��������Һ�еμ�KSCN��Һ����Һ���ɫ�����ǿ���������һ�������Fe3+�Ĵ��ڣ�
���𰸡�
��1�����ȣ� Al
��2��Na2O2�� NaHCO3
��3����
���������⣺��1��8Al+3Fe3O4 ![]() 4Al2O3+9Fe�Ƿ��ȷ�Ӧ��AlԪ�ػ��ϼ����ߣ���������Ϊ��ԭ�����ʴ�Ϊ�����ȣ�Al����2�����������ܹ���ˮ��������̼��Ӧ������������2Na2O2+2CO2=2Na2CO3+O2������ΪDZˮͧ�ͺ��������������Դ��̼���������ȷֽ�����̼���ơ�ˮ�Ͷ�����̼���ܹ������ᷴӦ�����ڱ��Ƹ�㣬Ҳ����������ҩ���ʴ�Ϊ��Na2O2��NaHCO3�� ��3���������ӵ���Һ�еμ�KSCN��Һ����Һ��ΪѪ��ɫ���ʴ�Ϊ���죮
4Al2O3+9Fe�Ƿ��ȷ�Ӧ��AlԪ�ػ��ϼ����ߣ���������Ϊ��ԭ�����ʴ�Ϊ�����ȣ�Al����2�����������ܹ���ˮ��������̼��Ӧ������������2Na2O2+2CO2=2Na2CO3+O2������ΪDZˮͧ�ͺ��������������Դ��̼���������ȷֽ�����̼���ơ�ˮ�Ͷ�����̼���ܹ������ᷴӦ�����ڱ��Ƹ�㣬Ҳ����������ҩ���ʴ�Ϊ��Na2O2��NaHCO3�� ��3���������ӵ���Һ�еμ�KSCN��Һ����Һ��ΪѪ��ɫ���ʴ�Ϊ���죮
��1����Ӧ8Al+3Fe3O4 ![]() 4Al2O3+9Fe�У�AlԪ�ػ��ϼ����ߣ���������Ϊ��ԭ����FeԪ�ػ��ϼ۽��ͣ�����ԭ��Al2O3Ϊ���������ɴ˷�����𣻣�2�����������ܹ���ˮ��������̼��Ӧ����������̼���������ȷֽ�����̼���ơ�ˮ�Ͷ�����̼����3���������ӵ���Һ�еμ�KSCN��Һ����Һ��ΪѪ��ɫ��
4Al2O3+9Fe�У�AlԪ�ػ��ϼ����ߣ���������Ϊ��ԭ����FeԪ�ػ��ϼ۽��ͣ�����ԭ��Al2O3Ϊ���������ɴ˷�����𣻣�2�����������ܹ���ˮ��������̼��Ӧ����������̼���������ȷֽ�����̼���ơ�ˮ�Ͷ�����̼����3���������ӵ���Һ�еμ�KSCN��Һ����Һ��ΪѪ��ɫ��

 һ����������ϵ�д�
һ����������ϵ�д�����Ŀ������ѡ�õ�������ҩƷ�ܴﵽʵ��Ŀ���ǣ�������
A | B | C | D |
|
| ����NaHSO3��Һ | |
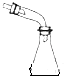
����Ȳ�ķ���װ�� | ����ʱ�Ľ���װ�� | ��ȥSO2�е�����HCl | ȷ��ȡһ�����K2Cr2O7����Һ |
A.A
B.B
C.C
D.D