题目内容
(14分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(混有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压强1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
请回答下列问题:
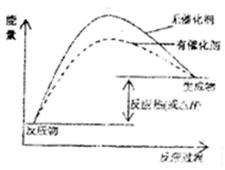
(1)请在方框内的坐标系中,画出反应(I)在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3日生成量的建议: 。
(3)写出工业上用H2和N2直接合成NH3的化学方程式 ,设在2.0 L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总物质的量之比)为4/7。计算该条件下N2的平衡转化率为 ;反应的平衡常数K= (不要求写单位)。
(1) (2)研制新型、高效催化剂
(2)研制新型、高效催化剂
(3)N2(g)+3H2(g)) 2NH3(g);66.7%;200
2NH3(g);66.7%;200
解析试题分析:(1)催化剂是通过降低反应的活化能来加快化学反应速率的,使用催化剂后,活化能降低,故图像为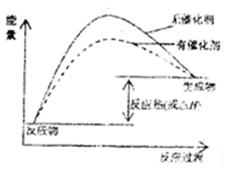 ;
;
(2)根据影响反应速率的因素:温度、浓度、压强、催化剂等外界因素,结合目前广泛使用的工业合成氨方法,可以采用增大压强的方法,此外还可以寻找高效的催化剂。
(3)H2和N2直接合成NH3的化学方程式为N2(g)+3H2(g)) 2NH3(g)。设平衡时有x molN2转化,则
2NH3(g)。设平衡时有x molN2转化,则
N2(g)+3H2(g)) 2NH3(g)
2NH3(g)
起始量(mol) 0.6 1.6 0
变化量(mol) x 3x 2x
平衡量(mol)(0.6-x)(1.6-3x) 2x mol
则有: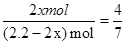
解得:x=0.4(mol)
因此N2的平衡转化率: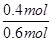 ×100%=66.7%
×100%=66.7%
②由①可知,N2、H2、NH3平衡时的物质的量分别为:0.2mol、0.4mol、0.8mol,在2.0L容器中浓度分别为:0.1mol/L、0.2mol/L、0.4mol/L,则该温度下平衡常数K=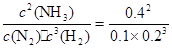 =200。
=200。
考点:考查外界条件对反应速率的影响、可逆反应的有关计算等

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案2014年初雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
①该反应在 能自发进行(填“高温下” 、“低温下” 或“任何温度下”);
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
| A.增加原催化剂的表面积 | B.降低温度 |
| C.减小投料比[n(NO2) / n(CH4)] | D.增大压强 |

从图中可以得出的结论是
结论一:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
推测原因是
结论二:
硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为______;生成SO3的化学反应速率为______。
(2)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
| A.压缩体积,增大压强 | B.降低温度 | C.充入大量的氮气 | D.仅增加SO2的浓度 |
(16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。
(1)已知某温度下:
反应①:CO2(g) +H2 (g)→CO(g) + H2O(g),ΔH= +41.2 kJ/mol
反应②: 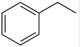 (g)→
(g)→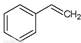 (g)+H2(g),ΔH=" +117.6" kJ/mol
(g)+H2(g),ΔH=" +117.6" kJ/mol
②的化学反应平衡常数分别为K1、K2。
请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是 。
| A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小; |
| B.若继续加入1molCO2、1mol H2,平衡向正反应方向移动; |
| C.若继续通入1mol CO2则平衡向正反应方向移动,CO2的转化率增大; |
| D.压缩体积,平衡不移动,反应物和产物的浓度都不变; |
(4)已知某温度下, Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ksp(Ag2SO4)= ;(两位有效数字)
(5)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH- = FeO42-+3H2,电解质溶液选用NaOH溶液。该电解池阳极材料是 (写化学式) ;阳极的电极反应式为: 。
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。汽车尾气中CO与H2O(g)在一定条件下可以发生反应:
CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
(1)该反应的平衡常数表达式为 。
(2)平衡时,甲容器中CO的转化率是 。比较下列容器中CO的转化率:乙 甲;丙 甲(填“>”、“=”或“<”)。
(3)丙容器中,若要通过改变温度,使CO的平衡转化率增大,则温度需要降低才能达到,则降温后的平衡常数K (填“增大”、“减小”或“不变”)。

 CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
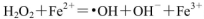
 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。


 .
. 2NH3,2 min后测得容器中生成了1mol NH3,试求:
2NH3,2 min后测得容器中生成了1mol NH3,试求: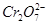 和
和 ,常用的方法有两种。
,常用的方法有两种。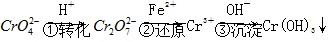 。
。