题目内容
环境中常见的重金属污染物有:汞.铅.锰.铬.镉。处理工业废水中含有的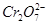 和
和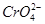 ,常用的方法有两种。
,常用的方法有两种。
方法1 还原沉淀法该法的工艺流程为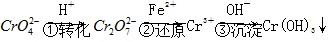 。
。
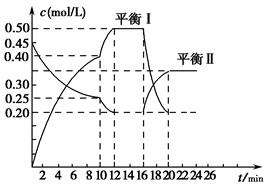
其中第①步存在平衡2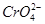 (黄色)+2H+
(黄色)+2H+
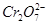 (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol 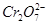 ,需要________mol的FeSO4·7H2O。
,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含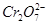 的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。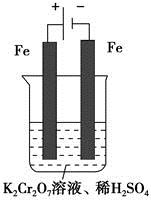
(1)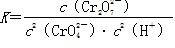 (2)AC (3)0.6
(2)AC (3)0.6
(4)Fe(OH)3 当pH调至4时,c(OH-)=10-10 mol·L-1,c(Cr3+)=10-32/c3(OH-)=10-2 mol·L-1>10-5 mol·L-1,因此Cr3+没有沉淀完全
(5)Fe-2e-=Fe2+ 2H++2e-=H2↑ 阳极生成的金属阳离子向阴极移动,阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-的浓度增大,溶液逐渐呈碱性
解析

 名校课堂系列答案
名校课堂系列答案(14分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(混有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压强1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
请回答下列问题:
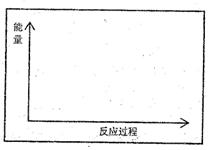
(1)请在方框内的坐标系中,画出反应(I)在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3日生成量的建议: 。
(3)写出工业上用H2和N2直接合成NH3的化学方程式 ,设在2.0 L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总物质的量之比)为4/7。计算该条件下N2的平衡转化率为 ;反应的平衡常数K= (不要求写单位)。
在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
ΔH<0,其化学平衡常数K与温度T的关系如下表:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题:
(1)试比较K1、K2的大小,K1________K2(填“>”“=”或“<”)
(2)下列各项能作为判断该反应达到化学平衡状态的依据的是________(填字母编号)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数K的值为________,当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,该反应的v正(N2)________v逆(N2)(填“>”“<”或“=”)
N2(g)+3H2(g)的化学平衡常数K的值为________,当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,该反应的v正(N2)________v逆(N2)(填“>”“<”或“=”)  2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。
 Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图: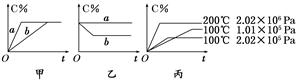
 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示: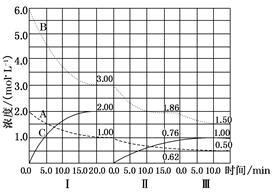
 3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。  yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题: