题目内容
(14分)加大对煤燃烧产生的废气、废渣的处理已刻不容缓。
(1) 对燃煤的废气进行脱硝处理时,可利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH=a kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH=b kJ·mol-1
则反应CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g)的ΔH=________ kJ·mol-1(用含a、b的代数式表示)。
(2) 将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
① 该反应平衡常数表达式为K=________。
② 已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图所示。该反应的ΔH________(填“>”“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”“减小”或“不变”)。
③ 二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为____________________________。
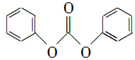
(3) 以CO2为原料合成的碳酸酯(仅含碳、氢、氧三种元素)是用途广泛的化学品,某种碳酸酯(DPC)水解产物之一遇氯化铁溶液显紫色,右图为它的核磁共振氢谱图,请写出DPC的结构简式:____________。
(4) 某电厂的粉煤灰含莫来石(主要成分为Al6Si2O13、SiO2)。将其和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式(反应条件均为高温)为:
Al6Si2O13+3Na2CO3===2NaAlSiO4+4NaAlO2+3CO2↑
Al6Si2O13+5Na2CO3===2Na2SiO3+6NaAlO2+5CO2↑
SiO2+Na2CO3===Na2SiO3+CO2↑
则用1 mol Al6Si2O13和4 mol SiO2通过以上反应制得5 mol NaAlO2,共消耗Na2CO3为________mol。
(1) (a+b)/2
(2) ① [c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2)] ② < 不变
③ CH3OCH3-12e-+3H2O===2CO2+12H+
(3) 
(4) 8
解析试题分析:(1)方程式(1+2)÷2得到对应方程式,焓变同方程式,ΔH=(a+b)/2 kJ·mol-1(2)由图可知,温度高CO2转化率低,平衡逆向移动,反应放热;平衡常数只与温度有关,温度不变,k不变;负极是二甲醚失去电子,转移电子数可以根据化合价确定;(3)根据信息确定形成酯的酸为碳酸,提共羟基的为酚,产物只有3中不同化学环境的氢且比值为2:2:1,由此确定为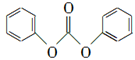 ;(4)反应中SiO2消耗Na2CO3,Al6Si2O13与Na2CO3发生两个反应,根据 反应物和产物列方程组解题,
;(4)反应中SiO2消耗Na2CO3,Al6Si2O13与Na2CO3发生两个反应,根据 反应物和产物列方程组解题,
设第1、2反应分别消耗Al6Si2O13的物质的量为x、y,则有
X+y=1
4x+6y=5
解得x=y=0.5mol
故共消耗Na2CO3为0.5×3+0.5×5+4=8mol
考点:考查化学反应原理综合有关问题。

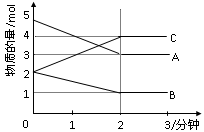
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 
| A.t2时加入了催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率最低 |
(5分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
(1)右图表示温度为T K时氮气与氢气合成氨反应过程中的能量变化, 写出该反应的热化学方程式 。
(2)已知在TK温度下合成氨反应在2.00L的密闭容器中进行。得到如下数据:
| 时间(h) 物质的量(mol) | | 0 | 1 | 2 | 3 | 4 |
| N2 | | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①0~1h内N2的平均反应速率为mol/(L·h)。
②反应进行到2h时放出的热量为 kJ。
③此条件下,反应:N2 + 3H2
 2NH3的化学平衡常数K = (保留两位小数)。
2NH3的化学平衡常数K = (保留两位小数)。④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡移动的方向是 (填“正反应”或“逆反应”或“不移动”)。
(16分)化学反应的能量变化、速率、限度是化学研究的重要内容。
(1)有关研究需要得到C3H8(g) = 3C(石墨,s) + 4H2(g)的ΔH,但测定实验难进行。设计下图可计算得到:
①ΔH 0(填>、<或=)
②ΔH =
(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料。它们的一些性质如下:
| 物质 | HCOOH | CH3OH | HCOOCH3 |
| 主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
 HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响。
甲醇: 。
甲酸: 。
某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%。
②预测HCOOCH3转化率随时间的变化趋势并画图表示。

③该反应在温度T1下的平衡常数K= 。
(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景。
写出该燃料电池的电极反应式:
。
(14分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(混有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压强1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
请回答下列问题:
(1)请在方框内的坐标系中,画出反应(I)在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3日生成量的建议: 。
(3)写出工业上用H2和N2直接合成NH3的化学方程式 ,设在2.0 L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总物质的量之比)为4/7。计算该条件下N2的平衡转化率为 ;反应的平衡常数K= (不要求写单位)。


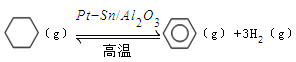 。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。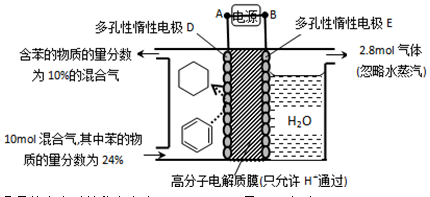
 =_____(
=_____( ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位) 2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。
 Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C