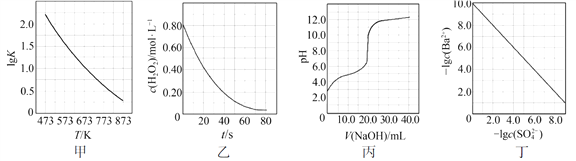
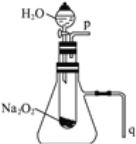
题目内容
【题目】草酸晶体的组成可用H2C2O4·2H2O(M=126g/mol)表示,其中混有不参与反应的杂质,为了测定草酸晶体的纯度,进行如下实验:称取m g样品,配成250mL水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为c mol·L-1的KMnO4溶液滴定,所发生的反应: KMnO4+ H2C2O4+ H2SO4 = K2SO4+ CO2↑+ MnSO4+ H2O.试回答:
(1)写出该反应的离子方程式并配平:_________________________________________,该反应发生时产生气体先慢后快的原因是_______________________________________________
(2)实验中,KMnO4溶液应装在_____式滴定管中,因为 ___________________。
(3)滴定过程中需要加入的指示剂为___________(填指示剂的名称或“不需要”),确定反应达到滴定终点时的现象是______________________________________。
(4)在滴定过程中若用c mol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为____________mol·L-1,由此可计算样品中草酸晶体的纯度是________。
【答案】2 MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O 生成Mn2+起催化剂 作用,加快反应速率 酸 高锰酸钾溶液具有强氧化性,可腐蚀橡胶管 不需要 溶液由无色变浅红色(粉红色),且半分钟不褪色 cV/10 315cV/m%
【解析】
(1)反应中锰元素化合价降低5价,草酸中碳元素化合价升高1价,则高锰酸根离子和草酸的比例为2:5,则根据质量守恒和电荷守恒得到离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O。随着反应进行反应物的浓度都在减小,反应速率加快只能是在反应过程中生成的锰离子起催化剂作用,加快了反应速率。(2)高锰酸钾溶液具有强氧化性,可腐蚀橡胶管,所以只能用酸式滴定管。 (3)高锰酸钾溶液有颜色,所以反应过程中不需要指示剂。滴定终点溶液由无色变浅红色(粉红色),且半分钟不褪色。(4) c mol·L-1的KMnO4溶液VmL滴定草酸,根据方程式2MnO4----5H2C2O4分析,设草酸的浓度为xmol/L,
2MnO4----5H2C2O4
2 5
cV x×25
有![]() ,则草酸的浓度为cV/10mol/L。草酸晶体的纯度为
,则草酸的浓度为cV/10mol/L。草酸晶体的纯度为![]() =315cV/m%。
=315cV/m%。

【题目】计算题
(1)某地产石灰石所含杂质不溶于水也不与盐酸反应。为测定该石灰石中碳酸钙的含量,现进行下列实验:称取25g石灰石放在质量为145g的烧杯中,向其中加入100g稀盐酸,反应恰好完全,此时称量烧杯及其中溶液,总质量为261.2g,求:
①石灰石中碳酸钙的质量为__________克。
②反应后溶液中溶质的质量分数为__________(保留两位有效数字)。
(2)某厂的某钢样粉末28.36 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3 g白色沉淀。
①计算可得此钢样粉末中铁和碳的质量之比为__________。
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2克 H2的体积为22.4L)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量 / g | 2.836 | 5.672 | 8.508 |
生成气体的体积(标准状况)/ L | 1.12 | 2.24 | 2.80 |
根据表中的数据计算,硫酸溶液中H2SO4溶质的质量分数是__________
【题目】下列因果关系不正确的是( )
选项 | 原因 | 结果 |
A | 大量植树造林 | 温室效应 |
B | SO2和NO2气体的大量排放 | 酸雨 |
C | 含氮、磷等生活废水的大量排放 | 水华、赤潮 |
D | 汽车尾气的大量排放 | 光化学烟雾 |
A. AB. BC. CD. D