题目内容
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下反应关系:
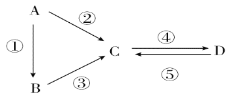
(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。写出反应④的化学方程式: _________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式: __________________________________________。
(3)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素位于同一主族,且溶液均显碱性。写出反应②的化学方程式: ___________________________。
(4)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式: ____________________________________。
(5)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式: _____________________________________________。
【答案】NaOH+CO2=NaHCO3 4NH3+5O2![]() 4NO+6H2O Si+2NaOH+H2O=Na2SiO3+2H2↑ AlO+CO2+2H2O=Al(OH)3↓+HCO3- 2Fe3++Fe=3Fe2+
4NO+6H2O Si+2NaOH+H2O=Na2SiO3+2H2↑ AlO+CO2+2H2O=Al(OH)3↓+HCO3- 2Fe3++Fe=3Fe2+
【解析】
(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。则A是Na,B是Na2O2,液态氢化物是H2O,C是NaOH,D是NaHCO3,则反应④的化学方程式NaOH+CO2=NaHCO3;
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2,A是N2,B为NH3,反应③是氨气的催化氧化反应,化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)若A是太阳能电池用的光伏材料,判断A为Si,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,说明盐水解呈碱性,C为Na2SiO3,D为Na2CO3,B为SiO2;反应②Si变为Na2SiO3反应,Si与NaOH溶液反应产生硅酸钠和氢气,反应的化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑;
(4)若D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断A为单质Al,B为AlCl3,反应④为向偏铝酸钠溶液中通入足量CO2气体,产生Al(OH)3沉淀的反应,方程式为:AlO+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质,推断该非金属单质为Cl2,可判断C为FeCl3,D为FeCl2,B为Fe2O3,C→D的离子方程式为:Fe+2Fe3+=3Fe2+,若A是应用最广泛的金属。反应④是Fe3+变为Fe2+,离子方程式为2Fe3++Fe=3Fe2+。


