题目内容
19.下列化学用语表述正确的是( )| A. | Na的原子结构示意图: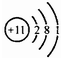 | B. | N2分子的结构式:N=N | ||
| C. | HC1的电子式: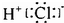 | D. | H2O分子的球棍模型: |
分析 A.原子的核电荷数=核外电子数=原子序数;
B.氮气的电子式中共用电子对有三对;
C.HCl是共价化合物;
D. 是水分子的比例模型.
是水分子的比例模型.
解答 解:A.核电荷数=核外电子数=原子序数,是Na的原子结构示意图,故A正确;
B.氮气的电子式中有3对共用电子对,结构式正确的写法为N≡N,故B错误;
C.HCl是共价化合物,不能用中括号,不用标电荷,故C错误;
D. 是水分子的比例模型,不是球棍模型,故D错误.
是水分子的比例模型,不是球棍模型,故D错误.
故选A.
点评 本题考查化学用语,题目较为简单,涉及比例模型、电子式等,注意有关概念的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列实验正确的是( )
| 实验名称 | 实验操作 | 实验现象 结论 | |
| A | 苯甲酸的重结晶 | ①加热溶解 ②趁热过滤 ③冷却结晶 | 将苯甲酸与溶性杂质分离 |
B | 溴乙烷法制乙烯并验证乙烯 | 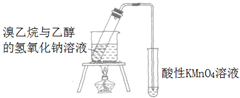 | 现象: KMnO4紫色褪去 结论: 证明有乙烯生成 |
C | 乙醇法制乙烯并验证乙烯 | 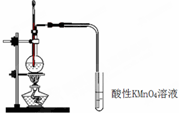 | 现象: KMnO4紫色褪去 结论: 证明有乙烯生 |
D | 验证乙酸、碳酸、苯酚溶液酸性强弱 | 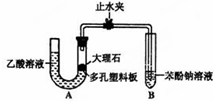 | 现象:A中大理石有气泡,B中溶液变浑浊 结论:酸性 乙酸强于碳酸强于苯酚 |
| A. | A | B. | B | C. | C | D. | D |
10.下列有关甲苯的实验事实中,与苯环上的甲基有关(或受其影响)的是( )
| A. | 甲苯与浓硫酸和浓硝酸的混合物反应生成邻硝基甲苯和对硝基甲苯 | |
| B. | 甲苯能使溴水褪色 | |
| C. | 甲苯燃烧产生带浓烟的火焰 | |
| D. | 1 mol甲苯与3 molH2发生加成反应 |
7.化学与生产生活息息相关,下列叙述正确的是( )
| A. | 次氯酸钠溶液作消毒剂,是因为钠盐能使蛋白质变性 | |
| B. | 工业电解熔融氧化铝冶炼铝,是因为氧化铝的成本比氯化铝低 | |
| C. | 生活中常用铁酱油、AD钙奶和钠盐,是因为铁、钙、碘都是人体必需元素 | |
| D. | 用硫化钠除去废水中的Hg2+、Cu2+,是因为硫化钠溶液是碱性,易生成氢氧化物沉淀 |
4.下列说法正确的是( )
| A. | 油脂在酸性条件下水解的反应称为皂化反应 | |
| B. | 煤的炼制方法中煤的气化和液化是物理方法,煤的干馏是化学方法 | |
| C. | 石油裂化的目的是提高轻质油的产量和质量 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 |
9. 思考下列问题,按要求填空:
思考下列问题,按要求填空:
(1)某温度下纯水中c(H+)=2×10-7mol/L,①此时溶液中的c(OH-)=2×10-7mol/L.
②若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6mol/L,则此时溶液中的c(OH-)=8×10-9mol/L
(2)已知下列热化学方程式:Zn(s)+21 O2(g)═ZnO(s)△H1=-351.1kJ•mol-1;
Hg(l)+21 O2(g)═HgO(s)△H2=-90.7kJ•mol-1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变为-260.4kJ/mol
(3)在稀氨水中存在下述电离平衡NH3+H2O?NH3•H2O?NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向”、“逆向”或“不移动”)
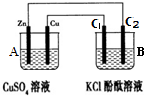
(4)如图所示,装置B中两电极均为石墨电极,试回答下列问题:
①判断装置的名称:A池为原电池.
②锌极为负极,电极反应式为Zn-2e-=Zn2+;
③当C2极析出224mL气体(标准状况下),锌的质量减少_0.65_g.
 思考下列问题,按要求填空:
思考下列问题,按要求填空:(1)某温度下纯水中c(H+)=2×10-7mol/L,①此时溶液中的c(OH-)=2×10-7mol/L.
②若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6mol/L,则此时溶液中的c(OH-)=8×10-9mol/L
(2)已知下列热化学方程式:Zn(s)+21 O2(g)═ZnO(s)△H1=-351.1kJ•mol-1;
Hg(l)+21 O2(g)═HgO(s)△H2=-90.7kJ•mol-1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变为-260.4kJ/mol
(3)在稀氨水中存在下述电离平衡NH3+H2O?NH3•H2O?NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向”、“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | 减小 | 减小 | 增大 |
| 平衡移动方向 | 逆向 | 正向 | 逆向 |
①判断装置的名称:A池为原电池.
②锌极为负极,电极反应式为Zn-2e-=Zn2+;
③当C2极析出224mL气体(标准状况下),锌的质量减少_0.65_g.

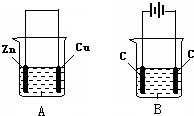 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: