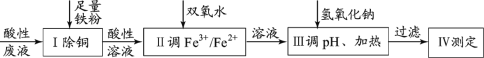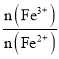题目内容
【题目】取 30.8g 甲酸铜[(HCOO)2Cu]在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A 和混合气体 B;若相同质量的甲酸铜在空气中充分加热,则生成黑色固体 D 和 CO2、H2O。固体 A 和 D 质量相差 2.4g。则:
(1)红色固体 A 中 Cu 单质的物质的量为_________mol。
(2)将混合气体B 置于O2 中充分燃烧,消耗 O2 的体积是_________L (换算为标准状况)。
【答案】0.1 2.8
【解析】
(1)n[(HCOO)2Cu]=![]() =0.2mol,在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A,设Cu的物质的量为x,Cu2O的物质的量为y,x+y=0.2mol,在空气中加热生成CuO,增加2.4g,x+y=
=0.2mol,在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A,设Cu的物质的量为x,Cu2O的物质的量为y,x+y=0.2mol,在空气中加热生成CuO,增加2.4g,x+y=![]() =0.15mol,解得x=0.1mol,y=0.05mol,故答案为:0.1;
=0.15mol,解得x=0.1mol,y=0.05mol,故答案为:0.1;
(2)由(1)甲酸铜[(HCOO)2Cu]在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A ,A中Cu的物质的量:Cu2O的物质的量=0.1mol:0.05mol=2:1,则(HCOO)2Cu分解的方程式为:4(HCOO)2Cu![]() 2Cu+Cu2O+4H2O+5CO+3CO2,0.2mol(HCOO)2Cu分解生成n(CO)=
2Cu+Cu2O+4H2O+5CO+3CO2,0.2mol(HCOO)2Cu分解生成n(CO)=![]() ×0.2mol=0.25mol,置于O2 中充分燃烧,消耗 O2 的体积是0.25mol×
×0.2mol=0.25mol,置于O2 中充分燃烧,消耗 O2 的体积是0.25mol×![]() ×22.4L·mol-1=2.8L,故答案为:2.8。
×22.4L·mol-1=2.8L,故答案为:2.8。

练习册系列答案
相关题目