题目内容
【题目】(1)羰基硫(COS)在常温常压下为有臭鸡蛋气味的无色气体,广泛应用于农药、医药和其他化工生产中。在酸性溶液中可用H2O2氧化COS生成一种强酸(脱硫反应)该脱硫反应的化学方程式为________。
(2)已知:①COS(g)+H2(g)![]() H2S(g)+CO(g)△H1=+11kJ·mo-1;
H2S(g)+CO(g)△H1=+11kJ·mo-1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=-21kJ·mol-l;
H2(g)+CO2(g) △H2=-21kJ·mol-l;
③COS(g)+H2O(g)![]() H2S(g)+ CO2(g) △H3=________
H2S(g)+ CO2(g) △H3=________
(3)用活性a-Al2O3催化COS水解,反应为 COS(g)+H2O(g)![]() CO2(g)+H2S(g)在催化剂表面停留时间相同时,不同温度下COS的转化率如图所示。
CO2(g)+H2S(g)在催化剂表面停留时间相同时,不同温度下COS的转化率如图所示。

由图可知,COS的转化率在后期下降的原因可能是________ 。
(4)COS可由CO和H2S在一定条件下反应制得,在刚性容器中发生反应:CO(g)+H2S(g)=COS(g) + H2(g)△H<0。初始时各物质的物质的量浓度与平衡时CO的物质的量浓度数据如下表所示:
实验 | 温度/℃ | 起始时/ molL-1 | 平衡时/ molL-1 | |||
c(CO) | c(H2S) | c(COS) | c(H2) | c(CO) | ||
Ⅰ | T1 | 20.0 | 20.0 | 0 | 0 | 16.0 |
Ⅱ | T2 | 10.0 | 10.0 | 0 | 0 | 7.0 |
Ⅲ | T3 | 7.0 | 8.0 | 2.0 | 4.5 | |
①T1_____(填“大于”“小于”或“等于”)T2。
②实验I中,8 min反应达到平衡,则08 min内v(COS)= _____molL-1,T![]() 时,该反应的平衡常数为_____。
时,该反应的平衡常数为_____。
③实验Ⅲ中的反应应_____(填“正向”或“逆向”)移动。
(5)反应COS(g)+H2(g)=H2S(g)+CO(g)的平衡常数K与温度T的关系式为lgK=aT+b(a,b均为常数),请在如图所示的坐标系中用直线画出lgK与温度T的关系图像_____。
【答案】COS+4H2O2=CO2+H2SO4+3H2O -10 kJ·mol-1 若反应没有达到平衡,可能是催化剂失效;若反应已达到平衡,反应为放热反应,温度升高平衡逆向移动;反应已达平衡,催化剂失效且反应放热,温度升高平衡逆向移动(任意两点即可) 大于 0.5 0.0625 正向 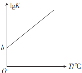
【解析】
(1)在酸性溶液中可用H2O2氧化COS生成一种强酸为硫酸,反应化学方程式为:COS+4 H2O2=CO2+H2SO4+3H2O,故答案为:COS+4H2O2=CO2+H2SO4+3H2O;
(2)①COS(g)+H2(g)![]() H2S(g)+CO(g)△H1=+11kJ·mo-1;
H2S(g)+CO(g)△H1=+11kJ·mo-1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=-21kJ·mol-l;
H2(g)+CO2(g) △H2=-21kJ·mol-l;
①+②可得③,根据盖斯定律:△H3=+11kJ·mo-1-21kJ·mol-l=-10 kJ·mol-1,故答案为:-10 kJ·mol-1;
(3)若反应没有达到平衡,可能是催化剂失效;若反应已达到平衡,反应为放热反应,温度升高平衡逆向移动;反应已达平衡,催化剂失效且反应放热,温度升高平衡逆向移动,故答案为:若反应没有达到平衡,可能是催化剂失效;若反应已达到平衡,反应为放热反应,温度升高平衡逆向移动;反应已达平衡,催化剂失效且反应放热,温度升高平衡逆向移动(任意两点即可);
(4)①根据实验Ⅰ、Ⅱ可以判断,起始量增大一倍,若温度不变,平衡时CO的物质的量为14mol,现在为16mol,说明平衡向逆反应方向移动,所以T1大于T2,故答案为:大于;
②根据三段式:
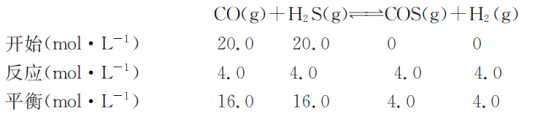
得v(COS)=![]() ;T1
;T1![]() 时,化学平衡常数:
时,化学平衡常数:![]() ;故答案为:0.5;0.0625;
;故答案为:0.5;0.0625;
③起始时,浓度商![]() ,T2
,T2![]() 时,化学平衡常数为
时,化学平衡常数为![]() ,反应应向正反应方向移动,故答案为:正向;
,反应应向正反应方向移动,故答案为:正向;
(5)关系式为lgK=aT+b,a与b均为常数,随着T的增大K增大,所以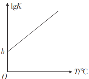 ,故答案为:
,故答案为: 。
。

【题目】下列依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液中或熔融状态下可以导电的化合物称为电解质 | CH3COOH水溶液中存在:CH3COOH |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 | H2O既是酸又是碱 |
C | Fe3Cl8可以改写为FeCl2·2FeC13 | Fe3I8可以改写为FeI·2FeI3 |
D | HCl在一定条件下能被MnO2氧化为Cl2 | HBr在一定条件下也能被MnO2氧化为Br2 |
A.AB.BC.CD.D