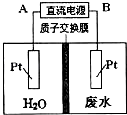
题目内容
【题目】Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)基态Fe2+的核外电子排布式为[Ar]______,有__个未成对电子。
(2)氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是_____。
(3)已知Al 的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因________。
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是____;SiO2中Si原子采取____杂化。
(5)一种铜的溴化物晶胞结构如图所示:该晶胞中铜的配位数是___,与溴紧邻的溴原子数目是________,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为________;已知晶胞参数为apm,其密度为_______g/cm3 (列出计算式即可)。

【答案】 3d6 4 氧化铝是离子晶体,而氯化铝是分子晶体 Al原子失去一个电子后,其3s上有2个电子为全充满状态、3p和3d为全空状态,较稳定 O>Si>Cu sp3 4 12 (1/4,1/4,1/4) 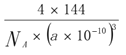
【解析】 (1)基态Fe2+的核外电子排布式为[Ar] 3d6,d轨道有5个,根据洪特规则可知其有4个未成对电子。
(2)氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是两者的晶体类型不同,氧化铝是离子晶体,其晶体具有较高的晶格能,而氯化铝是分子晶体,其分子间只存在微弱的分子间作用力。
(3)已知Al的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。其第二电离能增幅较大的原因是:Al原子失去一个电子后,其3s上有2个电子为全充满状态、3p和3d是全空状态,故较稳定。
(4) 非金属性越强的元素,其电负性越大,所以,Cu、Si、O元素电负性由大到小的顺序是O>Si>Cu;SiO2中每个Si原子与其周围的4个O原子形成共价键,所以Si原子采取sp3杂化。
(5)由图可知,该晶胞中,溴原子的数目为![]() ,铜原子的数目为4,每个铜原子周围有4个溴原子,所以铜的配位数是4,该化合物的化学式为CuBr。溴原子位于晶胞的顶点和面心,所以与溴紧邻的溴原子数目是
,铜原子的数目为4,每个铜原子周围有4个溴原子,所以铜的配位数是4,该化合物的化学式为CuBr。溴原子位于晶胞的顶点和面心,所以与溴紧邻的溴原子数目是![]() =12。R点位于晶胞的左下前方的八分之一立方的体心,P点是顶点位于坐标原点,Q点为面心,由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为(1/4,1/4,1/4);已知晶胞参数为apm,NA个晶胞的体积和质量分别为
=12。R点位于晶胞的左下前方的八分之一立方的体心,P点是顶点位于坐标原点,Q点为面心,由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为(1/4,1/4,1/4);已知晶胞参数为apm,NA个晶胞的体积和质量分别为![]() 、
、![]() ,所以其密度为
,所以其密度为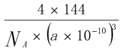 g/cm3。
g/cm3。