题目内容
甲、乙两种金属性质比较:
①甲的单质熔、沸点比乙的低;
②常温下,甲能与水反应放出氢气而乙不能;
③最高价氧化物对应的水化物碱性比较,乙比甲的强;
④甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡.
上述项目中能够说明甲比乙的金属性强的是( )
①甲的单质熔、沸点比乙的低;
②常温下,甲能与水反应放出氢气而乙不能;
③最高价氧化物对应的水化物碱性比较,乙比甲的强;
④甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡.
上述项目中能够说明甲比乙的金属性强的是( )
| A、①② | B、②④ | C、②③ | D、①③ |
考点:常见金属的活动性顺序及其应用
专题:几种重要的金属及其化合物
分析:比较金属性的强弱,可利用失电子的难易程度、阳离子的氧化性,最高价氧化物的水化物的碱性、与水或酸反应的剧烈程度、单质之间的置换反应、原电池原理等来判断.
解答:
解:①甲的单质熔、沸点比乙的低,无法确定甲、乙的得电子能力,故①错误;
②常温下,甲能与水反应放出氢气而乙不能,甲的金属性比乙的强,故②正确;
③最高价氧化物对应的水化物碱性比较,乙比甲的强,则乙的金属性比甲的强,故③错误;
④甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡,则甲的金属性比乙的强,故④正确;
故选B.
②常温下,甲能与水反应放出氢气而乙不能,甲的金属性比乙的强,故②正确;
③最高价氧化物对应的水化物碱性比较,乙比甲的强,则乙的金属性比甲的强,故③错误;
④甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡,则甲的金属性比乙的强,故④正确;
故选B.
点评:本题考查了元素金属性的判断,知道元素金属性的判断方法有哪些,注意其金属性强弱与得失电子难易程度有关,与得失电子多少无关,为易错点.

练习册系列答案
相关题目
NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、1mol乙烷(CH3CH3)中含有共价键的数目为6NA |
| B、由CO2和O2组成的混合气体共有NA个分子,其中氧原子数为2NA |
| C、标准状况下,22.4L H2O中含氢原子数为2NA |
| D、制取84消毒液(NaClO),消耗0.5mol氯气转移电子数为NA |
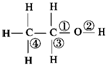 乙醇在一定条件下,发生催化氧化反应时,化学键断裂位置是图中的( )
乙醇在一定条件下,发生催化氧化反应时,化学键断裂位置是图中的( )| A、②③ | B、②④ | C、①③ | D、③④ |
下列化学用语表述正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、水分子的电子式: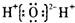 |
C、甲烷分子的比例模型: |
D、氯离子的结构示意图: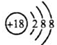 |
利用ZnFe2O4/(Fe3O4,Zn)两步热化学循环制氢气系统如图所示,下列说法不正确的是( )


| A、图中能量转化方式只有1种 | ||||
B、两步总反应为:2H2O
| ||||
| C、氢能是一种清洁、高效、安全、可持续的新能源 | ||||
D、H2生产步骤反应为:3Zn+2Fe3O4+4H2O
|
解决“白色污染”问题,下列做法不宜提倡的是( )
| A、使用新型可降解塑料 |
| B、用布袋代替塑料袋 |
| C、回收废弃塑料 |
| D、焚烧废弃塑料 |
下列反应属于吸热反应的是( )
| A、葡萄糖在人体内氧化供能 |
| B、氢气在氧气中燃烧 |
| C、氢氧化钡晶体与氯化铵晶体反应 |
| D、氢氧化钾溶液和硫酸中和 |
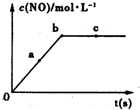 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位.工业制硝酸的主要反应之一是4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-akJ?mol-1(a>0)
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位.工业制硝酸的主要反应之一是4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-akJ?mol-1(a>0)