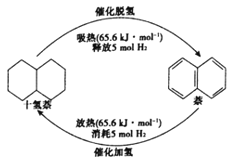
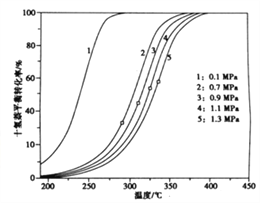
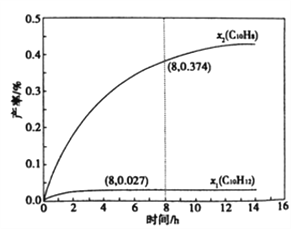
题目内容
【题目】酸碱完全中和时
A. 酸和碱的物质的量一定相等
B. 酸所提供的H+与碱提供的OH-的物质的量相等
C. 酸和碱的物质的量浓度相等
D. 溶液一定呈中性
【答案】B
【解析】试题分析:A、完全中和时,酸碱的物质的量不一定相等,如H2SO4和NaOH的中和反应,故错误;B、完全中和是:酸所提供的H+与碱提供的OH-的物质的量相等,故正确;C、根据选项B的分析,故错误;D、溶液可能显酸性、碱性或中性,故错误。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
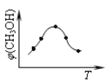
优翼小帮手同步口算系列答案【题目】Ⅰ、反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是_________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”、“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?_____(填“有”、“无”),原因是____。
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1____(填“增大”、“减小”、“不变”)。
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) ![]() PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)50~150s内的平均反应速率v(PCl3)=___________。
(2)该温度下,此反应的化学平衡常数的数值为___________(可用分数表示)。
(3)反应至250s时,该反应放出的热量为______________kJ。
(4)下列关于上述反应的说法中,正确的是__________(填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.5molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如下。其他条件相同,请在下图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线__________。