题目内容
【题目】Ⅰ、反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是_________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”、“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?_____(填“有”、“无”),原因是____。
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1____(填“增大”、“减小”、“不变”)。
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) ![]() PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)50~150s内的平均反应速率v(PCl3)=___________。
(2)该温度下,此反应的化学平衡常数的数值为___________(可用分数表示)。
(3)反应至250s时,该反应放出的热量为______________kJ。
(4)下列关于上述反应的说法中,正确的是__________(填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.5molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如下。其他条件相同,请在下图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线__________。

【答案】 放热 减小 无 催化剂不改变反应物总能量与生成物总能量之差即反应热不变 减小 0.6×10-3 mol/(Ls)或0.0006mol/(Ls) 0.83或5/6 0.372 abd 
【解析】I.(1)由图象可以看出反应物总能量大于生成物的总能量,则该反应的正反应为放热反应。
(2)该反应正反应为放热反应,当反应达到平衡时,升高温度使平衡向逆反应方向移动,A的转化率减小。
(3)催化剂不改变反应物总能量与生成物总能量之差,即反应热不变,所以对反应热无影响。
(4)加入催化剂能降低反应物的活化能,则E1减小。
Ⅱ.(1)由实验数据:50s时n(PCl5)=0.24mol,150s时n(PCl5)=0.36mol,所以50~150s内生成PCl50.12mol,由化学方程式可得,50~150s内反应的PCl3为0.12mol,所以50~150s内的平均反应速率v(PCl3)=0.12mol÷2.0L÷100s=0.0006mol/(Ls)[或0.6×10-3 mol/(Ls)]。
(2)250s时反应达到平衡状态,此时产物的物质的量为0.40mol,由已知列“三段式”得:
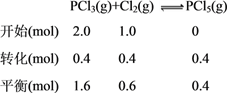
容积为2.0L,计算各物质在平衡时的物质的量浓度为:c(PCl5)=0.2mol/L、c(PCl3)=0.8mol/L、c(Cl2)=0.3mol/L,所以平衡常数K=![]() =
=![]() =
=![]() ≈0.83。
≈0.83。
(3)反应至250s时,生成0.4molPCl5,放出的热量为0.4mol×0.930 kJmol-1=0.372kJ。
(4)反应物和生成物都是气态,气体总质量不变,容器的容积恒定,所以无论是否达平衡状态,混合气体的密度始终不变,故a正确;升高温度,化学反应速率增大,正、逆反应速率同时增大,故b正确;容器的容积恒定,350s时,向该密闭容器中充入氮气,与该反应没有关系,平衡不移动,故c错误;该反应正向是气体分子数减小的反应,所以降低压强不利于PCl5的生成,相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.5molCl2,则与充入2.0 mol PCl3和1.0 mol Cl2达到的平衡相比不等效,相当于减压,所以达到化学平衡状态时,n(PCl5)<0.20mol,故d正确。综上,选abd。
(5)升高温度,化学反应速率加快,达到平衡用的时间减少;该反应正向为放热反应,升高温度,平衡时PCl5的体积分数降低,所以温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线如图: 。
。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案