题目内容
【题目】十氢奈是具有高储氢密度的氢能载体,经历“十氢奈(C10H18 )→四氢奈(C10H12)→奈(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢奈的常压沸点为192℃;在192℃,液态十氢奈的脱氢反应的平衡转化率约为9%。请回答:
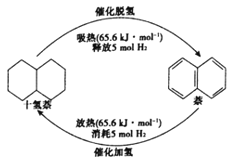
(1)每1mol 十氢萘液体可储存5mol氢气,可运载到使用氢气的场所,在催化剂的作用下释放氢气,生成的液体萘可重复催化加氢来储存氢气,如图所示,则△H1+△H2=__________。
(2)有利于提高上述反应平衡转化率的条件是__________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)不同压力和温度下十氢萘的平衡转化率如图所示,结合图示回答问题:
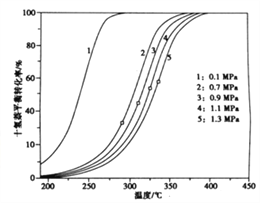
①在相同压强下升高温度,未达新平衡前,v正__________v逆(填写“大于”“小于”或“等于”)。
②研究表明,将适量的十氢奈置于恒容密闭反应器中,既升高温度又增大压强,十氢萘的转化率也升高,可能理由是______________________________________。
(4)温度335℃,在恒容密闭反应器中进行高压液态十氢奈(1.00 mol)催化脱氢实验,测得液态C10H12和液态C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图所示。
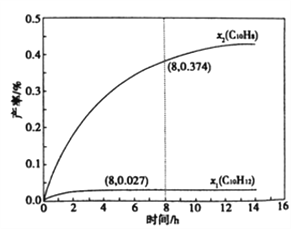
①在8h时,反应体系内氢气的量为_______mol(忽略其他副反应),液态十氢奈的转化率是____。
②x1显著低于x2的原因是_______________________________________________。
【答案】 65.6kJ·mol-1 C 大于 升高温度正向移动的程度大于加压逆向移动的程度 1.95 40.1% 四氢萘转化为萘的活化能小,反应速率很快,生成的四氢萘大部分转化为萘,因此x1显著低于x2
【解析】(1)根据盖斯定律,已知中的两个反应热化学方程式相加得:C10H18(l)![]() C10H8(l)+5H2(g) △H1+△H2,由图可得:△H1+△H2=65.6kJ·mol-1。
C10H8(l)+5H2(g) △H1+△H2,由图可得:△H1+△H2=65.6kJ·mol-1。
(2)由上面的分析可得,该反应是吸热反应,且生成物气体分子数增大,所以高温低压有利于提高平衡转化率,故选C。
(3)①由图像可得,在相同压强下升高温度,十氢萘的平衡转化率增大,则未达新平衡前,v正>v逆。②升高温度有利于该反应正向移动,增大压强有利于该反应逆向移动,将适量的十氢奈置于恒容密闭反应器中,既升高温度又增大压强,十氢萘的转化率也升高,可能是升高温度正向移动的程度大于增大压强逆向移动的程度。
(4)①温度335℃,在恒容密闭反应器中进行高压液态十氢奈催化脱氢实验,十氢萘(C10H18)初始为1.00 mol,如图所示,在8 h时测得C10H12和C10H8的产率x1=0.027,x2=0.374,即生成C10H12和C10H8的物质的量分别为0.027mol、0.374mol,设反应的C10H18的物质的量为n1,反应的C10H12的物质的量为n2,根据反应关系:

则n1-n2=0.027mol,n2=0.374mol,所以n1=0.401mol,因此生成的氢气的物质的量为:3n1+2n2=3×0.401mol+2×0.374mol=1.951mol≈1.95mol;十氢萘(C10H18)的转化率为: ![]() ×100%=
×100%=![]() ×100%=40.1%。②因为△H1>△H2>0,C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,所以Ea1>Ea2,即四氢萘转化为萘的活化能小,相同温度下反应速率更快,所以相同时间内,生成的四氢萘大部分都转化为萘,故x1显著低于x2。
×100%=40.1%。②因为△H1>△H2>0,C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,所以Ea1>Ea2,即四氢萘转化为萘的活化能小,相同温度下反应速率更快,所以相同时间内,生成的四氢萘大部分都转化为萘,故x1显著低于x2。

 智能训练练测考系列答案
智能训练练测考系列答案