题目内容
用两支惰性电极插入500mL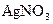 溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是
溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是
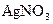 溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是
溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是| A.54mg | B.81mg | C.108mg | D.216mg |
A
略

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
题目内容
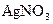 溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是
溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是| A.54mg | B.81mg | C.108mg | D.216mg |

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案