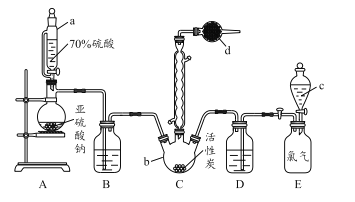
题目内容
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
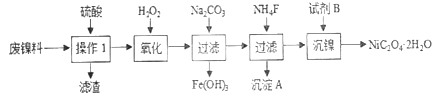
(1)操作1的名称为__________。
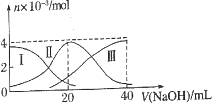
(2)保持其他条件相同,在不同温度下对废镍料进行“酸浸”,镍浸出率随时间变化如图。“酸浸”的适宜温度与时间分别为_______(填字母)。
a.30℃、30min b.70℃、120min
c.90℃、150min d.90℃、120min
(3)沉淀A为CaF2和_________(填化学式)。
(4)试剂B的化学式为_________________。
(5)NiC2O4·2H2O样品经某稀酸酸化处理后,用稀KMnO4标准溶液滴定[在本实验条件下,Ni(Ⅱ)不能被氧化,其他物质不参与反应],通过测定草酸的量可测定NiC2O4·2H2O样品的纯度,滴定反应为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O。实验中称取0.183g样品,滴定时消耗了0.0400mol.L-1的KMnO4溶液8.00mL,则该样品中NiC2O4·2H2O的质量分数为_________。
(6)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体![]() 现象
现象![]() 现象
现象![]()
![]() 现象
现象![]() 现象
现象
①试剂1的名称为____________。
②证明混合气体有CO的现象是_____________________________________________。
【答案】 过滤 b MgF2 H2C2O4或Na2C2O4(或可溶性的草酸盐等) 80.0% (无水)硫酸铜 黑色氧化铜(试剂2)变红色,澄清石灰水(试剂3)变浑浊(答案合理即可)
【解析】(1)镍废料中的镍、铁、钙、镁均可以和硫酸反应没生成硫酸盐,且硫酸钙属于微溶物,经过过滤除去不反应的杂质,和硫酸钙的不溶物,故操作1为过滤。
(2)根据图中的数据,在30℃、30 min时,镍的浸出率只有不到80%,此浸出率太低;在90℃时,120 min和150 min时的浸出率接近;而在120 min时,70℃和90℃时的浸出率相同。考虑经济效益还是选择低温合算,故选b。
由图知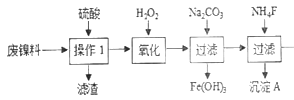 操作1除去了不溶的硫酸钙双氧水氧化Fe2+为Fe3+,加碳酸钠调节PH使Fe3+沉淀出来,加氟化铵,产生的沉淀为CaF2和MgF2。答案:MgF2。
操作1除去了不溶的硫酸钙双氧水氧化Fe2+为Fe3+,加碳酸钠调节PH使Fe3+沉淀出来,加氟化铵,产生的沉淀为CaF2和MgF2。答案:MgF2。
经过上述处理,除去铁、钙、镁等杂质,由图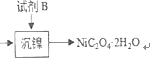 知试剂B为H2C2O4或Na2C2O4(或可溶性的草酸盐等)答案:H2C2O4或Na2C2O4(或可溶性的草酸盐等)
知试剂B为H2C2O4或Na2C2O4(或可溶性的草酸盐等)答案:H2C2O4或Na2C2O4(或可溶性的草酸盐等)
(5)根据反应方程式为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O 根据反应关系
5NiC2O4·2H2O---- 5H2C2O4-----2 MnO4-
X 0.0400mol.L-1![]() 8.00mL/1000
8.00mL/1000
X=8![]() 10-4mol
10-4mol
样品中NiC2O4·2H2O的质量分数为=8![]() 10-4mol
10-4mol![]() 183g/moL/0.183g=80.0%
183g/moL/0.183g=80.0%
(6) ① 高温煅烧NiC2O4的产物为三氧化二镍.CO、CO2、水蒸气,检验生成物时应先检验水,所以试剂1为无水硫酸铜.答案: 硫酸铜 。
②证明混合气体有CO的现象是
混合气体![]() 现象
现象![]() 现象
现象![]()
![]() 现象
现象![]() 现象
现象
根据上图知试剂1为硫酸铜,鉴别水,澄清的石灰水,鉴别CO2,试剂2为检验CO,可用黑色氧化铜粉末变红,再用澄清石灰水(试剂3)变浑浊即可。答案 :黑色氧化铜(试剂2)变红色。澄清石灰水(试剂3)变浑浊

【题目】现有六种元素,其中A、B、C、D、E为短周期主要族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ1=738kJ·mol-1;Ⅰ2=1451kJ·mol-1;Ⅰ3=7733kJ·mol-1;Ⅰ4=10540kJ·mol-1; |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)B元素的电负性_____(填“大于”、“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为_____________。
(4)E基态原子中能量最高的电子,其电子云在空间有__________个方向。
(5)下列关于F原子的价层电子排布图正确的是___________。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(6)基态F3+离子核外电子排布式为_____________。过量单质F与B的最高价氧化物的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为____________。
(7)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是__________________。