题目内容
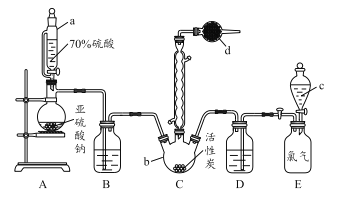
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
已知:
①SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ/mol
SO2Cl2(l) △H=-97.3 kJ/mol
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是_____________________。
(2)仪器d中盛放的试剂为______。
A.无水硫酸铜 B.无水氯化钙 C.碱石灰 D.五氧化二磷
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为 ___________________。
(4) 装置E为储气装置,用于提供氯气,则分液漏斗c中盛放的试剂为_________。当装置E中排出氯气0.224 L(已折算成标准状况)时,最终得到1.08 g纯净的硫酰氯,则硫酰氯的产率为_____。
(5)长期存放的硫酰氯会发黄,其原因可能为__________________________________。
【答案】平衡分液漏斗内外压强,便于液体顺利流下C2ClSO3H![]() SO2Cl2+H2SO4饱和食盐水80%硫酰氯中溶有其分解产生的氯气
SO2Cl2+H2SO4饱和食盐水80%硫酰氯中溶有其分解产生的氯气
【解析】
(1)仪器a为恒压分液漏斗,可以平衡分液漏斗内外气压,便于液体流下;装置C中SO2与Cl2反应产生硫酰氯,硫酰氯在潮湿空气中“发烟”,所以要用碱石灰防止空气中的水分进入装置C,同时吸收过量的氯气或二氧化硫,防止进入空气中污染环境;(3)由原子个数守恒可知,另外物质为H2SO4;(4)氯气溶于水,不溶于饱和食盐水;由氯气物质的量可以计算理论上生成SO2Cl2的质量,从而求硫酰氯的产率;(5)100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气,氯气为黄绿色气体,可能是溶解氯气所致。
(1)仪器a为恒压分液漏斗,可以平衡分液漏斗内外气压,便于液体流下;(2)装置C中SO2与Cl2反应产生硫酰氯,硫酰氯在潮湿空气中“发烟”,所以要用碱石灰防止空气中的水分进入装置C,同时吸收过量的氯气或二氧化硫,所以选C;(3)氯磺酸(C1SO3H)加热分解制得硫酰氯(SO2Cl2)与另外一种物质,由元素守恒可知,另外物质含有H元素,C1SO3H中S、Cl原子数目之比为1:1,而SO2Cl2中S、Cl原子数目之比为1:2,故另外物质中含有S元素,结合原子守恒可知另外物质为H2SO4,反应方程式为:2C1SO3H![]() SO2Cl2+H2SO4;(4)利用分液漏斗中的液体将装置E的氯气排出,与二氧化硫在装置C中反应,分液漏斗可以为饱和食盐水;氯气的物质的量为
SO2Cl2+H2SO4;(4)利用分液漏斗中的液体将装置E的氯气排出,与二氧化硫在装置C中反应,分液漏斗可以为饱和食盐水;氯气的物质的量为![]() =0.01mol,由方程式可知n(SO2Cl2)=n(Cl2)=0.01mol,故理论上生成SO2Cl2的质量为0.01mol×135g/mol=1.35g,故其产率为
=0.01mol,由方程式可知n(SO2Cl2)=n(Cl2)=0.01mol,故理论上生成SO2Cl2的质量为0.01mol×135g/mol=1.35g,故其产率为![]() ×100%=80%;(5)由信息③可知,硫酰氯易分解生成二氧化硫和氯气,硫酰氯分解产生氯气溶于硫酰氯导致硫酰氯发黄。
×100%=80%;(5)由信息③可知,硫酰氯易分解生成二氧化硫和氯气,硫酰氯分解产生氯气溶于硫酰氯导致硫酰氯发黄。