题目内容
【题目】二氧化硫是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O=CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是_______(用元素符号填写)。
(2)氧和硫属于同族元素,写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________________________________。
(3)NaOH的电子式为______________ 。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式______________。
(5)钠一钙联合处理法的优点有________________。(任写一点即可)
【答案】H<O<S<Na2H2S+O2![]() 2S +2H2O
2S +2H2O![]() 2NaOH+Na2SO3+Br2 = Na2SO4+2NaBr+H2ONaOH吸收SO2的效率高;NaOH能循环利用;生石灰价格较低,成本低
2NaOH+Na2SO3+Br2 = Na2SO4+2NaBr+H2ONaOH吸收SO2的效率高;NaOH能循环利用;生石灰价格较低,成本低
【解析】
(1)两步反应所涉及的短周期元素中H、O、S、Na,原子半径由小到大的顺序是H<O<S<Na;(2)用氧置换硫;(3)NaOH是离子化合物;(4)溴将亚硫酸根离子氧化;
(1)两步反应所涉及的短周期元素中H、O、S、Na,H原子只有一个电子层,OS同主族,从上到下,原子半径变大,Na和S同一周期,从左到右变小,原子半径由小到大的顺序是H<O<S<Na;(2)比较氧元素和硫元素非金属性强弱的化学反应方程2H2S+O2![]() 2S +2H2O (3)NaOH的电子式为
2S +2H2O (3)NaOH的电子式为![]() ;(4)溴将亚硫酸根离子氧化: 2NaOH+Na2SO3+Br2 = Na2SO4+2NaBr+H2O;(5)钠一钙联合处理法的优点有NaOH吸收SO2的效率高;NaOH能循环利用;生石灰价格较低,成本低。
;(4)溴将亚硫酸根离子氧化: 2NaOH+Na2SO3+Br2 = Na2SO4+2NaBr+H2O;(5)钠一钙联合处理法的优点有NaOH吸收SO2的效率高;NaOH能循环利用;生石灰价格较低,成本低。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
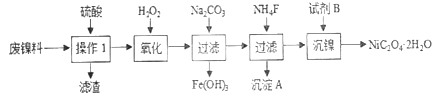
小学生10分钟应用题系列答案【题目】活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:

一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
pH | 3.2 | 6.7 | 8.0 | 9.7 |
(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是_____________________________。
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质。先加入___________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2,,经检测溶液中Fe2+的浓度为0.009mol·L-1,则每升溶液中至少应加入__________mol KMnO4。
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是___________。
(4)“沉淀”后所得“滤渣”的成分为ZnCO3·2Zn(OH)2·H2O,其在450~500℃下进行“煅烧”,“煅烧”反应的化学方程式为____________________________。