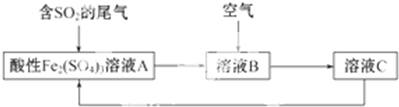
题目内容
14.溶解、过滤、蒸发操作中,都用到的仪器是( )| A. | 滤纸 | B. | 烧杯 | C. | 酒精灯 | D. | 玻璃棒 |
分析 溶解、过滤和蒸发三步中均用到的仪器为玻璃棒,据此解题.
解答 解:溶解、过滤和蒸发三步中均用到的仪器为玻璃棒,起到的作用分别是:溶解时是搅拌,加速溶解;过滤时的作用是引流;蒸发时的作用是搅拌,防止液体飞溅,
故选D.
点评 本题考查了物质的分离提纯过程中涉及到的方法和仪器的选择,难度不大,根据实验需要来分析即可.

练习册系列答案
相关题目
16.将4.6g钠和4.8g镁分别投入盛有等物质的量浓度、等体积的稀硫酸的两个烧杯中,反应后溶液质量分别为m g和n g,则不可能的关系为( )
| A. | m=n | B. | m>n | C. | m<n | D. | m≤n |
5.下列反应的离子方程式正确的是( )
| A. | 碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 25mL 0.3mol•L-1的FeBr2溶液中通入224mL标准状况下的氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 100mL 0.1mol•L-1的Al2(SO4)3溶液中加入20mL 3.5mol•L-1的NaOH溶液:Al3++4OH-═[Al(OH)4]- | |
| D. | 过量铁粉和稀硝酸反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
19.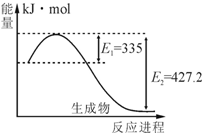 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)已知:N2(g)+3H2(g)?2NH3(g),如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量Q为46.1KJ;在该条件下向一密闭容器中充入0.5molN2和1.5mol H2,充分反应后,放出的热量<(填“<”、“>”或“=”)QkJ,理由是因为该反应是可逆反应,反应物不能完全转化.
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)已知:N2(g)+3H2(g)?2NH3(g),如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量Q为46.1KJ;在该条件下向一密闭容器中充入0.5molN2和1.5mol H2,充分反应后,放出的热量<(填“<”、“>”或“=”)QkJ,理由是因为该反应是可逆反应,反应物不能完全转化.
(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,得到如下数据:
请回答下列问题:
①实验1中以υ(H2) 表示的反应速率为0.45mol/(L•min);
②下列各项能作为判断该反应达到化学平衡状态的依据的是C(填序号字母);
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.υ(N2)(正)=3υ(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③为提高H2平衡时的转化率,可以采取的措施有AC
A.通入过量的N2 B.升高温度 C.增大压强 D.通入过量的H2.
 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)已知:N2(g)+3H2(g)?2NH3(g),如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量Q为46.1KJ;在该条件下向一密闭容器中充入0.5molN2和1.5mol H2,充分反应后,放出的热量<(填“<”、“>”或“=”)QkJ,理由是因为该反应是可逆反应,反应物不能完全转化.
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)已知:N2(g)+3H2(g)?2NH3(g),如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量Q为46.1KJ;在该条件下向一密闭容器中充入0.5molN2和1.5mol H2,充分反应后,放出的热量<(填“<”、“>”或“=”)QkJ,理由是因为该反应是可逆反应,反应物不能完全转化.(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 2分钟/mol | |
| H2 | N2 | NH3 | ||
| 1 | 298 | 6 | 2 | 1.2 |
| 2 | 398 | 3 | 1 | 0.8 |
①实验1中以υ(H2) 表示的反应速率为0.45mol/(L•min);
②下列各项能作为判断该反应达到化学平衡状态的依据的是C(填序号字母);
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.υ(N2)(正)=3υ(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③为提高H2平衡时的转化率,可以采取的措施有AC
A.通入过量的N2 B.升高温度 C.增大压强 D.通入过量的H2.
3.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,3.2 g O2所含氧原子的数目为0.2 NA | |
| B. | 含有NA个阴离子的Na2O2与足量水反应,转移电子数为2NA | |
| C. | 标准状况下,等体积的水和CO2,含有的氧原子数目为1:2 | |
| D. | 1L 1mol/L饱和FeCl3滴入沸水中完全水解生成Fe(OH)3胶体粒子个数为NA个 |