题目内容
【题目】重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。同时,由于其具有致癌作用,也是环境污染物之一,必须进行处理。工业上通常以铬铁矿(主要成分为FeOCr2O3,另外还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾,主要流程如下图所示:
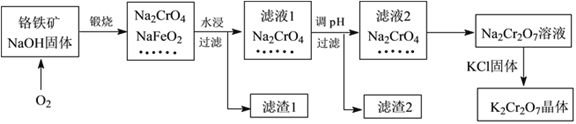
已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
请回答下列问题:
Ⅰ.(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有(填化学式)_________________;
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是_______(填字母代号);
a.溶液的颜色不变
b.v (CrO42—)= 2v (Cr2O72—)
c.Cr2O72—和CrO42—的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、______________、过滤、洗涤、干燥。
Ⅱ.工业废水中常含有一定量的Cr2O72—和CrO42—,常用还原沉淀法处理。该方法的工艺流程为:
![]()
(4)请写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式___________________;
(5)已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使第步过程中c(Cr3+)降至10-5mol/L,溶液的pH应调至__________________________。
【答案】 NaAlO2、NaOH a 冷却结晶 Cr2O72― + 6 Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O 5
【解析】煅烧时,铬铁矿中FeOCr2O3、SiO2、Al2O3分别转化为NaFeO2、Na2CrO4、Na2SiO3和NaAlO2。水浸时,NaFeO2遇水强烈水解,生成红褐色物质是氢氧化铁,另外还生成氢氧化钠;
Ⅰ.(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有NaAlO2、NaOH ;
(2)由滤液2转化为Na2Cr2O7溶液过程中,由2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O可知,溶液由黄色转化为橙红色,所以当溶液颜色不变时能说明反应达平衡状态,选a; b.v (CrO42—)= 2v (Cr2O72—)不能表示正反应速率和逆反应速率相等,所以不能说明反应是否达到平衡状态;c.Cr2O72—和CrO42—的浓度相同不能表示它们的浓度不再发生变化,所以也不能说明反应达到平衡状态。
Cr2O72—(橙色)+H2O可知,溶液由黄色转化为橙红色,所以当溶液颜色不变时能说明反应达平衡状态,选a; b.v (CrO42—)= 2v (Cr2O72—)不能表示正反应速率和逆反应速率相等,所以不能说明反应是否达到平衡状态;c.Cr2O72—和CrO42—的浓度相同不能表示它们的浓度不再发生变化,所以也不能说明反应达到平衡状态。
(3)根据流程,向Na2Cr2O7溶液中加入KCl固体可以获得K2Cr2O7晶体,说明在反应混合物中,重铬酸钾的溶液度是最小的,而氯化钠的溶液度随温度变化不大,所以可以用加热浓缩、冷却结晶、过滤、洗涤、干燥等一系列操作得到K2Cr2O7晶体。
Ⅱ.(4)由流程可知,Cr2O72―可以FeSO4溶液在酸性条件下还原为Cr3+,而Fe2+被氧化为Fe3+,所以反应的离子方程式为Cr2O72― + 6 Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O;
(5)已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使第步过程中c(Cr3+)降至10-5mol/L,根据Ksp=c(Cr3+)![]() (OH-),可得c(OH-)=
(OH-),可得c(OH-)= mol/L,所以c(H+)=10-5mol/L,pH= -lgC(H+)=5,所以溶液的pH应调至5。
mol/L,所以c(H+)=10-5mol/L,pH= -lgC(H+)=5,所以溶液的pH应调至5。