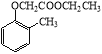题目内容
【题目】已知信息:[Cu(NH3)4]SO4的电离方程式为:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。 具有6个配体的Co3+的配合物CoClm·n NH3,若1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,则m、n的值分别是
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=3,n=3
【答案】B
【解析】
试题分析:1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,这说明分子中有1个氯离子不是配体。又因为钴元素是+3价的,所以m=3。由于配位数是6,则n=4,答案选B。

练习册系列答案
相关题目
【题目】阅读下表中短周期主族元素的相关信息。
元素 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强喊性溶液 |
B | B的原子最外层电子数是其内层电子数的3倍 |
C | 在第三周期元素中,C的简单离子半径最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
(1) E在元素周期表中的位置是_____________________。
(2) X的化学式为____________________
(3) A、B、C三种元素形成的简单离子半径由大到小的顺序为________________ (用离子符号表示)。
(4)A的单质在真空高压下能与由元素D、E组成的化合物ED4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称。写出该反应的化学方程式:____________。