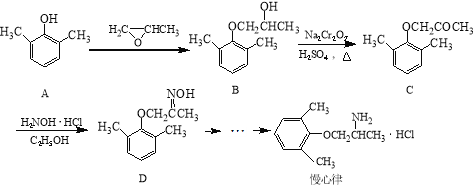
题目内容
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_____________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的 最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为_________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是__________
【答案】 +3 H3AsO4![]() H++H2AsO4- 沉淀过量的S2-,使As2O3(a)+3S2-(aq)
H++H2AsO4- 沉淀过量的S2-,使As2O3(a)+3S2-(aq)![]() 2AsS32-(aq) 平衡左移,提高沉砷效果。 H3AsO3+H2O2=H3AsO4+H2O CaSO4
2AsS32-(aq) 平衡左移,提高沉砷效果。 H3AsO3+H2O2=H3AsO4+H2O CaSO4 ![]() 12Ag++2AsH3+3H2O=12Ag+As2O3+12H+ 不符合 因为该废渣砷含量最少为(3.0×10-6g÷10g)×1000g/kg=3.0×10-4g/kg,大于排放标准4.0×10-5g/kg
12Ag++2AsH3+3H2O=12Ag+As2O3+12H+ 不符合 因为该废渣砷含量最少为(3.0×10-6g÷10g)×1000g/kg=3.0×10-4g/kg,大于排放标准4.0×10-5g/kg
【解析】(1)①亚砷酸(H3AsO3)中,氧元素化合价为-2价,氢元素化合价为+1价,砷元素化合价设为x,+1×3+x+(-2)×3=0,x=+3,故答案为:+3;
②第ⅤA族非金属元素形成最高价含氧酸中磷、砷形成的含氧酸都是弱酸,水溶液中分步电离,电离方程式为:H3AsO4H++H2AsO4-,故答案为:H3AsO4H++H2AsO4-;
③“一级沉砷”中FeSO4的作用是除去过量的硫离子,As2S3+3S2-2AsS32-使平衡逆向进行,提高沉砷效果,故答案为:除去过量的硫离子,As2S3+3S2-2AsS32-使平衡逆向进行,提高沉砷效果;
④“二级沉砷”中H2O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸;,反应的化学方程式为:H3AsO3+H2O2=H3AsO4+H2O,故答案为:H3AsO3+H2O2=H3AsO4+H2O;
⑤流程分析可知,加入氧化钙和水反应生成氢氧化钙,氢氧化钙和砷酸反应生成砷酸钙沉淀、和铁离子反应生成氢氧化铁沉淀,钙离子结合硫酸根离子形成硫酸钙沉淀,所以沉淀X为CaSO4,故答案为:CaSO4;
(2)①AsH3和氨气分子结构相同为共价化合物,砷原子和三个氢原子形成三个As-H键,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
②将AsH3气体通人AgNO3溶液中,生成银镜和As2O3,结合电荷守恒、原子守恒配平书写离子方程式为:12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+,故答案为:12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+;
③As的最低检出限为3.0x10-6g,取1g废渣样品,重复上述实验,未见银镜生成,取10g废渣样品最后生成银镜和As2O3.则10g废渣含砷量最少为3.0x10-6g,含砷量大于3.0×10-4g/kg>4.0×10一5gkg-1,不符合排放标准,故答案为:不符合;因为该废渣砷含量最少为(3.0×10-6g÷10g)×1000g/kg=3.0×10-4g/kg,大于排放标准4.0×10-5g/kg。